题目内容
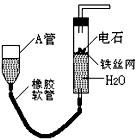
 如图的实验装置可用于实验室中制取乙炔.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔.请回答下列问题:(1)图中,A管的作用是
调节水面高度以控制反应的发生和停止
调节水面高度以控制反应的发生和停止
,制取乙炔的化学方程式为CaC2+2H2O═Ca(OH)2+C2H2↑
CaC2+2H2O═Ca(OH)2+C2H2↑
.(2)将制得的乙炔通入酸性KMnO4溶液中可观察到的现象是
KMnO4溶液褪色
KMnO4溶液褪色
,这是由于乙炔发生了氧化
氧化
反应.(3)将制得的乙炔通入溴的四氯化碳溶液中可观察到的现象是
溴的四氯化碳溶液褪色
溴的四氯化碳溶液褪色
,这是由于乙炔发生了加成
加成
反应,写出该反应的化学方程式C2H2+2Br2=CHBr2CHBr2
C2H2+2Br2=CHBr2CHBr2
.(4)为了安全,乙炔气体在点燃前应
检查乙炔的纯度
检查乙炔的纯度
,乙炔燃烧时的现象是火焰明亮并伴有浓烈的黑烟
火焰明亮并伴有浓烈的黑烟
.分析:(1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生氧化反应;
(3)乙炔能使溴的四氯化碳溶液褪色发生加成反应;
(4)可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟.
(2)乙炔能使酸性高锰酸钾溶液褪色,发生氧化反应;
(3)乙炔能使溴的四氯化碳溶液褪色发生加成反应;
(4)可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟.
解答:解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:调节水面高度以控制反应的发生和停止;CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:KMnO4溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,故答案为:溴的四氯化碳溶液褪色;加成;C2H2+2Br2=CHBr2CHBr2;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟,故答案为:检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟.
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:KMnO4溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,故答案为:溴的四氯化碳溶液褪色;加成;C2H2+2Br2=CHBr2CHBr2;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟,故答案为:检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟.
点评:本题考查乙炔的实验室制法和性质,注意A管的作用是易错点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
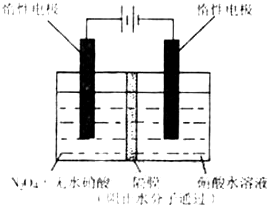 (2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.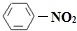

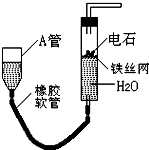 如图的实验装置可用于实验室中制取乙炔.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔.请回答下列问题: