题目内容
 (2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
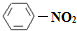
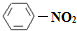
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将
不变
不变
.(填“增大”、“减小”、“不变”)②下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率为
0.00296 mol?L-1?s-1
0.00296 mol?L-1?s-1
.| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
<
<
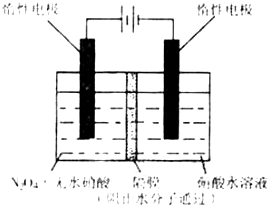
T1.(2)如图所示装置可用于制备N2O5,则N2O5在电解池的
阳极
阳极
区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+
N2O4+2HNO3-2e-=2N2O5+2H+
.分析:(1)硝基苯的结构简式是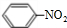 ;
;
(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,根据v=
计算N2O5的分解速率;
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
×4.98mol?L-1=2.51mol/L,高于在T1温度下,反应1000s时测得NO2的浓度,说明该温度下反应正向进行程度小;
(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成.
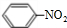 ;
;(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,根据v=
| △c |
| △t |
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
| 1 |
| 2 |
(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成.
解答:解:(1)硝基苯的结构简式是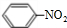 ,故答案为:
,故答案为: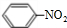 ;
;
(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,故答案为:不变;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为
=0.00296 mol?L-1?s-1;
故答案为:0.00296 mol?L-1?s-1;
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
×4.98mol?L-1=2.51mol/L,高于在T1温度下,反应1000s时测得NO2的浓度,说明该温度下反应正向进行程度小,故温度T2<T1,
故答案为:<;
(3)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-=2N2O5+2H+.
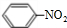 ,故答案为:
,故答案为: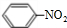 ;
;(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,故答案为:不变;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为
| 1.48mol/L |
| 500s |
故答案为:0.00296 mol?L-1?s-1;
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
| 1 |
| 2 |
故答案为:<;
(3)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-=2N2O5+2H+.
点评:本题为拼合型,涉及化学反应速率计算、化学平衡移动与计算、平衡常数的计算与运用、电解原理等知识点,题量大,计算量较大,是对学生心理素质的考验,题目难度较高,注意掌握平衡常数在化学平衡计算的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
