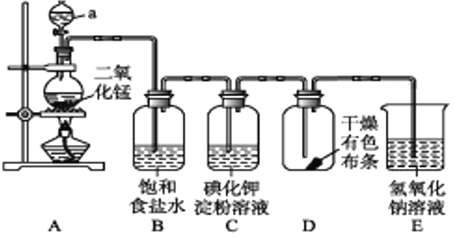
题目内容
【题目】现有1﹣20号元素A、B、C、D所对应的物质的性质或微粒结构如下:
①A的原子M层上有6个电子;
②B2+与D﹣具有相同的电子层结构,且可以相互组合形成常见干燥剂;
③元素C的单质常温为双原子气体分子,其氢化物水溶液呈碱性;
④元素D的最高正化合价为+7价.请回答下列问题:
(1)B的离子与D的离子相互组合形成的干燥剂的化学式是 .
(2)元素C与氢元素形成带一个单位正电荷的离子,为10电子微粒,写出该微粒的电子式(用元素符号表示) .
(3)元素A与元素D相比,非金属性较强的是(用元素符号表示),下列表述中能
证明这一事实的是 .
a.常温下A的单质和D的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D单质能从A的氢化物水溶液中置换出A单质
d.HD的酸性比HA酸性强.
【答案】
(1)CaCl2
(2)![]()
(3)Cl;bc
【解析】解:现有1﹣20号元素,A原子M层上有6个,则A是S元素;D元素最高正价是+7价,属于第VIIA族元素,且原子序数小于20,F元素没有正化合价,所以D是Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,氯化钙能作干燥剂,所以B是Ca元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,则C是N元素,(1)B的离子与D的离子相互组合形成的干燥剂CaCl2 , 所以答案是:CaCl2;(2)元素C与氢元素形成带一个单位正电荷的离子,该离子是NH4+离子,其电子式为: ![]() ,所以答案是:
,所以答案是: ![]() ;(3)同一周期元素,元素的非金属性随着原子序数的增大而增大,所以氯元素非金属性大于硫,a.单质的状态,属于物理性质,不能比较非金属性强弱,故a错误;b.Cl元素非金属性比S强,故HCl比硫化氢稳定,故b正确;c.一定条件下氯气能从硫化氢水溶液中置换出S单质,说明氯元素非金属性比S强,故c正确;d.氢化物溶液酸性强弱不能说明元素非金属性强弱,若非金属性F>Cl,但酸性HF<HCl,故d错误.
;(3)同一周期元素,元素的非金属性随着原子序数的增大而增大,所以氯元素非金属性大于硫,a.单质的状态,属于物理性质,不能比较非金属性强弱,故a错误;b.Cl元素非金属性比S强,故HCl比硫化氢稳定,故b正确;c.一定条件下氯气能从硫化氢水溶液中置换出S单质,说明氯元素非金属性比S强,故c正确;d.氢化物溶液酸性强弱不能说明元素非金属性强弱,若非金属性F>Cl,但酸性HF<HCl,故d错误.
所以答案是:Cl;bc.