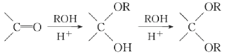
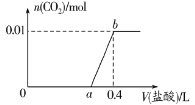
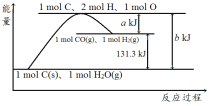
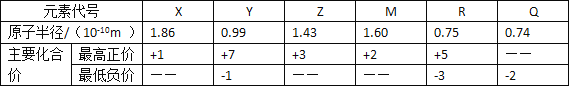
题目内容
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列方程式正确且能设计成原电池的是________。
A.KOH+HCl=KCl+H2O
B.Cu+Fe3+=Fe2++Cu2+
C.Na2O+H2O=2NaOH
D.Fe+H2SO4=FeSO4+H2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(图Ⅰ、图Ⅱ中除连接的铜棒不同外,其他均相同)。有关实验现象,下列说法正确的是___________。

A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速度比Ⅰ快
(3)将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80,工作一段时间后,取出二者洗净,干燥后称重,总质量为54g,则产生氢气的体积_____mL(标准状况)
(4)将铝片和镁片放入氢氧化钠溶液中,负极的电极反应式为:______________
【答案】D AD 8960mL Al-3e-+4OH-=AlO2-+2H2O
【解析】
(1)利用构成原电池的条件进行分析;
(2)从原电池能量的利用、影响化学反应速率的因素等角度进行分析;
(3)根据电极反应式,前后质量差应是消耗的锌的质量,然后进行分析;
(4)铝片能与氢氧化钠溶液发生反应,镁不与氢氧化钠溶液反应,因此Al为负极,然后进行分析;
(1)依据原电池是自发进行的氧化还原反应判断;
A.该反应为复分解反应,不是氧化还原反应,故A不符合题意;
B.该反应电荷不守恒,离子方程式不正确,故B不符合题意;
C.该反应不存在化合价变化,不属于氧化还原反应,故C不符合题意;
D.该反应是自发进行的氧化还原反应,可以设计成原电池,故D符合题意;
(2)图I中发生的是锌的化学腐蚀,图II形成铜锌原电池,
A.图I主要是将化学能转化为热能,图II主要是将化学能转化为电能,则图I中温度计的示数高于图II的示数,故A符合题意;
B.根据选项A的分析,两个装置温度计中示数不相等,但均高于室温,故B错误;
C.图Ⅱ为原电池,Cu为正极,铜的表面有气泡产生,故C错误;
D.利用原电池反应可以加快反应速率,图Ⅱ中产生气体的速率比I快,故D正确;
答案:AD;
(3)锌比银活泼,锌为负极,电极反应式为Zn-2e-=Zn2+,锌极质量减少,银极为正极,电极反应式为2H++2e-=H2↑,电极质量不变,因此反应前后电极总质量差为消耗锌极的质量,即消耗锌极的质量为(80-54)g=26g,其物质的量为0.4mol,建立关系是Zn~2e-~H2,产生氢气的体积为0.4mol×22.4L·mol-1=8.96L,即为8960mL;
(4)虽然镁比铝活泼,但铝单质能与氢氧化钠溶液发生氧化还原反应,镁不与氢氧化钠溶液反应,因此Al为负极,Mg为正极,电极反应式为Al-3e-+4OH-=AlO2-+2H2O。

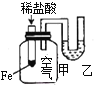
【题目】下列实验现象不能充分说明相应的化学反应是放热反应的是
选项 | A | B | C | D |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |
A. A B. B C. C D. D