题目内容
18.室温下,pH=12的NaOH和pH=2的H2SO4等体积混合,所得溶液的pH为多少?分析 pH=12的NaOH溶液中c(OH-)=10-1mol/L,pH=2的H2SO4溶液中c(H+)=10-2mol/L,氢氧化钠溶液中的氢氧根离子与硫酸中的氢离子浓度相等,则等体积混合后恰好反应生成硫酸钠,溶液呈中性.
解答 解:室温下,pH=12的NaOH溶液中氢氧根离子的浓度为c(OH-)=10-2mol/L,
pH=2的H2SO4溶液中c(H+)=10-2mol/L,
两溶液等体积混合,混合液中氢离子与氢氧根离子的浓度相等,二者恰好反应生成硫酸钠和水,
则反应后的溶液呈中性,溶液的pH=7,
答:所得溶液的pH为7.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.设NA代表阿伏加德罗常数,下列对于0.3mol/L的H2SO4溶液的说法不正确的是( )
| A. | 2L溶液中含有0.6NA个SO42-离子 | |
| B. | 2L溶液中H+离子的浓度为1.2mol/L | |
| C. | 1L溶液中含有H+离子0.6mol | |
| D. | 1L溶液中含溶质阴阳离子的总数为0.9NA个 |
10.元素原子最外层电子层上只有一个电子,该元素( )
| A. | 一定是金属元素 | B. | 不一定是金属元素 | ||
| C. | 一定是ⅠA族元素 | D. | 一定是非主族元素 |
8.下列粒子结构示意图中,表示阳离子的是( )
| A. | 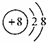 | B. | 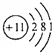 | C. |  | D. |  |
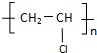 、
、 、
、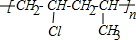 .
.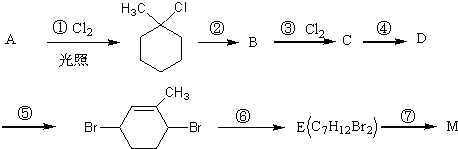
 C
C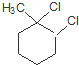 M
M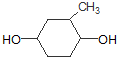
 +HCl④
+HCl④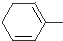 +2NaOH+2H2O
+2NaOH+2H2O