题目内容
化学在生产生活中有着重要的应用,下列有关说法正确的是( )
分析:A.蛋白质遇到强碱会变性,蛋白质就失去了生物活性;
B.明矾不能使蛋白质变性,所以不能用于水的消毒、杀菌;
C.铁活泼性比锡强,铁被腐蚀;
D.胶体的分散质的直径大小为1-100 nm.
B.明矾不能使蛋白质变性,所以不能用于水的消毒、杀菌;
C.铁活泼性比锡强,铁被腐蚀;
D.胶体的分散质的直径大小为1-100 nm.
解答:解:A.生石灰遇水会发生反应放出大量的热,并且生成强碱可以使细菌的蛋白质失去活性从而起到杀菌的作用,故A正确;
B.明矾不能使蛋白质变性,所以不能用于水的消毒、杀菌,明矾中的铝离子能水解生成氢氧化铝胶体,能吸附水中的悬浮颗粒,所以明矾能净水,故B错误;
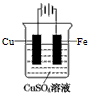
C.铁活泼性比锡强,铁与锡形成原电池时铁作负极被腐蚀,所以可在船身上装锡块,不能防止铁被腐蚀,故C错误;
D.胶体的分散质的直径大小为1-100 nm,所以PM2.5是指大气中直径小于或等于2.5×l0-6米的颗粒物,也称可入肺颗粒物,其分散在空气中能形成胶体,故D错误.
故选A.
B.明矾不能使蛋白质变性,所以不能用于水的消毒、杀菌,明矾中的铝离子能水解生成氢氧化铝胶体,能吸附水中的悬浮颗粒,所以明矾能净水,故B错误;
C.铁活泼性比锡强,铁与锡形成原电池时铁作负极被腐蚀,所以可在船身上装锡块,不能防止铁被腐蚀,故C错误;
D.胶体的分散质的直径大小为1-100 nm,所以PM2.5是指大气中直径小于或等于2.5×l0-6米的颗粒物,也称可入肺颗粒物,其分散在空气中能形成胶体,故D错误.
故选A.
点评:本题考查明矾净水的原理、蛋白质的变性、金属的防护,胶体等,难度不大,注意根据有关原理和物质的性质分析即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
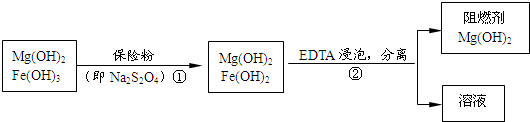
 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解