题目内容
镁的化合物在生产生活中有着比较重要的用途.
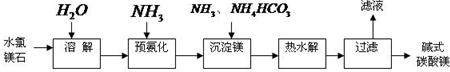
I、氢氧化镁是一种重要的绿色阻燃剂,某工厂合成氢氧化镁的流程如下:

(1)氢氧化镁可以作为阻燃剂的原因是
(2)步骤①中的反应如下:6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O
每消耗0.5mol保险粉(Na2S2O4)时,转移电子的数目是
(3)EDTA与溶液中的Fe2+反应可生成易溶于水的物质,而不与Mg(OH)2反应.步骤②中加入EDTA最终能够将Fe(OH)2除去并获得高纯度的Mg(OH)2的原因是
Ⅱ、铝和镁的碱式碳酸盐是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的
NaOH溶液得到5.22g白色沉淀.
试通过计算确定该碱式碳酸盐的化学式
I、氢氧化镁是一种重要的绿色阻燃剂,某工厂合成氢氧化镁的流程如下:

(1)氢氧化镁可以作为阻燃剂的原因是
氢氧化镁分解要吸收大量的热
氢氧化镁分解要吸收大量的热
.(写一条即可)(2)步骤①中的反应如下:6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O
每消耗0.5mol保险粉(Na2S2O4)时,转移电子的数目是
3
3
NA.(3)EDTA与溶液中的Fe2+反应可生成易溶于水的物质,而不与Mg(OH)2反应.步骤②中加入EDTA最终能够将Fe(OH)2除去并获得高纯度的Mg(OH)2的原因是
Fe(OH)2悬浊液中存在如下沉淀溶解平衡:Fe(OH)2 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解Fe(OH)2悬浊液中存在如下沉淀溶解平衡:Fe(OH)2 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
. Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解Ⅱ、铝和镁的碱式碳酸盐是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的
NaOH溶液得到5.22g白色沉淀.
试通过计算确定该碱式碳酸盐的化学式
Al2Mg6(OH)16CO3?4H2O
Al2Mg6(OH)16CO3?4H2O
.分析:Ⅰ、(1)氢氧化镁分解放出水蒸气和耐高温的固体氧化镁,分解过程中吸收大量的热,水蒸气能稀释氧气,氧化镁固体能隔绝氧气或空气;
(2)依据离子方程式的元素化合价变化结合氧化还原反应的电子守恒计算得到;
(3)依据氢氧化亚铁存在溶解沉淀平衡,加入EDTA时结合亚铁离子促进平衡正向进行氢氧化亚铁溶解;
Ⅱ、甲同学取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g,固体为氧化铝和氧化镁的质量;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况),生成的气体是二氧化碳物质的量为0.015mol,依据元素守恒得到碳酸根离子物质的量为0.015mol;继续向溶液中加入足量的NaOH溶液得到5.22g白色沉淀为氢氧化镁沉淀,依据镁元素守恒得到镁元素物质的量;
依据碱式盐总重量计算得到水的物质的量,结合计算得到的离子物质的量之比写出化学式.
(2)依据离子方程式的元素化合价变化结合氧化还原反应的电子守恒计算得到;
(3)依据氢氧化亚铁存在溶解沉淀平衡,加入EDTA时结合亚铁离子促进平衡正向进行氢氧化亚铁溶解;
Ⅱ、甲同学取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g,固体为氧化铝和氧化镁的质量;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况),生成的气体是二氧化碳物质的量为0.015mol,依据元素守恒得到碳酸根离子物质的量为0.015mol;继续向溶液中加入足量的NaOH溶液得到5.22g白色沉淀为氢氧化镁沉淀,依据镁元素守恒得到镁元素物质的量;
依据碱式盐总重量计算得到水的物质的量,结合计算得到的离子物质的量之比写出化学式.
解答:解:I、(1)Mg(OH)2
MgO+H2O↑.氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,
故答案为:氢氧化镁分解要吸收大量的热;
(2)反应中元素化合价变化分析,6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O,铁元素化合价降低转移电子6mol,反应的S2O42-的物质的量为1mol,每消耗0.5mol保险粉(Na2S2O4)时,转移电子的数目是3NA,故答案为:3;
(3)EDTA与溶液中的Fe2+反应可生成易溶于水的物质,而不与Mg(OH)2反应.步骤②中加入EDTA最终能够将Fe(OH)2除去并获得高纯度的Mg(OH)2的原因Fe(OH)2悬浊液中存在如下沉淀溶解平衡:Fe(OH)2?Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解,
故答案为:Fe(OH)2悬浊液中存在如下沉淀溶解平衡:Fe(OH)2?Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解;
Ⅱ、9.03g碱式碳酸盐中,含:
n(Mg2+)=n[Mg(OH)2]=
=0.09mol
n(Al3+)=2n(Al2O3)=2×(5.13g-0.09mol×40g/mol)÷102g/mol=0.03mol
n(CO32-)=n(CO2)=
=0.015 mol
n(OH-)=(0.09mol×2+0.03mol×3-0.015mol×2)=0.24mol
n(H2O)=(9.03g-0.09mol×24g/mol-0.03mol×27g/mol-0.015mol×60g/mol-0.24mol×17g/mol)÷18g/mol=0.06mol
所以n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.03mol:0.09mol:0.24mol:0.015mol:0.06mol=2:6:16:1:4;
即碱式碳酸盐的化学式为:Al2Mg6(OH)16CO3?4H2O,
故答案为:Al2Mg6(OH)16CO3?4H2O.
| ||
故答案为:氢氧化镁分解要吸收大量的热;
(2)反应中元素化合价变化分析,6Fe(OH)3+S2O42-+2OH-=6Fe(OH)2+2SO42-+4H2O,铁元素化合价降低转移电子6mol,反应的S2O42-的物质的量为1mol,每消耗0.5mol保险粉(Na2S2O4)时,转移电子的数目是3NA,故答案为:3;
(3)EDTA与溶液中的Fe2+反应可生成易溶于水的物质,而不与Mg(OH)2反应.步骤②中加入EDTA最终能够将Fe(OH)2除去并获得高纯度的Mg(OH)2的原因Fe(OH)2悬浊液中存在如下沉淀溶解平衡:Fe(OH)2?Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解,
故答案为:Fe(OH)2悬浊液中存在如下沉淀溶解平衡:Fe(OH)2?Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解;
Ⅱ、9.03g碱式碳酸盐中,含:
n(Mg2+)=n[Mg(OH)2]=
| 5.22g |
| 58g/mol |
n(Al3+)=2n(Al2O3)=2×(5.13g-0.09mol×40g/mol)÷102g/mol=0.03mol
n(CO32-)=n(CO2)=
| 0.336L |
| 22.4L/mol |
n(OH-)=(0.09mol×2+0.03mol×3-0.015mol×2)=0.24mol
n(H2O)=(9.03g-0.09mol×24g/mol-0.03mol×27g/mol-0.015mol×60g/mol-0.24mol×17g/mol)÷18g/mol=0.06mol
所以n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.03mol:0.09mol:0.24mol:0.015mol:0.06mol=2:6:16:1:4;
即碱式碳酸盐的化学式为:Al2Mg6(OH)16CO3?4H2O,
故答案为:Al2Mg6(OH)16CO3?4H2O.
点评:本题考查了物质制备实验方法,物质组成的计算应用,氧化还原反应的电子转移计算,镁、铝及其化合物性质的分析判断,题目难度中等.

练习册系列答案
相关题目