题目内容
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去)以初步确定其成分.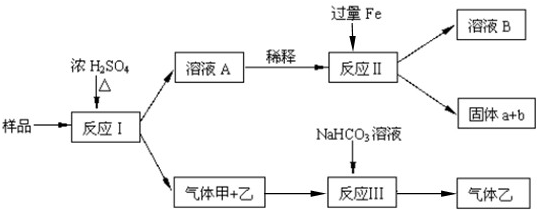
(1)取少量溶液A,加入过量氨水,有沉淀生成.过滤后向沉淀物中加入NaOH溶液,沉淀物的量无明显变化,说明样品中不含有的物质是
(2)写出反应Ⅰ中同时生成两种气体甲和乙的化学方程式
(3)写出反应Ⅱ中生成红色固体b的离子方程式
(4)气体甲和乙经过反应Ⅲ,反应后溶液中增加的一种离子是
分析:(1)氢氧化铝能够与酸反应生成铝离子,铝离子与氨水生成氢氧化铝,氢氧化铝可以溶于氢氧化钠,而加入氢氧化钠沉淀没有变化,据此进行判断;
(2)出反应Ⅰ中铁和铝与浓硫酸发生钝化,只有碳和浓硫酸加热反应生成二氧化碳和二氧化硫气体;
(3)反应Ⅱ中生成红色固体b为铜单质,原混合物中含有氧化铜,氧化铜与浓硫酸反应生成硫酸铜,铁与铜离子反应生成单质铜,据此写出生成铜的离子方程式;
(4)气体甲和乙为二氧化碳和二氧化硫,根据二氧化硫能够与碳酸氢钠溶液反应进行判断.
(2)出反应Ⅰ中铁和铝与浓硫酸发生钝化,只有碳和浓硫酸加热反应生成二氧化碳和二氧化硫气体;
(3)反应Ⅱ中生成红色固体b为铜单质,原混合物中含有氧化铜,氧化铜与浓硫酸反应生成硫酸铜,铁与铜离子反应生成单质铜,据此写出生成铜的离子方程式;
(4)气体甲和乙为二氧化碳和二氧化硫,根据二氧化硫能够与碳酸氢钠溶液反应进行判断.
解答:解:(1)金属铝可以和酸反应生成可溶性的铝盐,该铝盐可以和过量氢氧化钠反应生成偏铝酸盐,偏铝酸盐中通入二氧化碳反应可以获得氢氧化铝,故样品中不含有Al,故答案为:Al;
(2)碳与浓硫酸在加热条件下反应生成二氧化碳和二氧化硫,反应方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(3)反应Ⅱ中生成红色固体b为金属铜,说明原混合物中含有氧化铜,加入浓硫酸后溶液中生成了铜离子,再加入铁粉,铁粉与铜离子反应生成铜单质,反应的离子方程式为:Cu2++Fe═Cu+Fe2+,
故答案为:Cu2++Fe═Cu+Fe2+;
(4)气体甲和乙为二氧化碳和二氧化硫的混合气体,通过碳酸氢钠溶液时,二氧化硫与碳酸氢钠溶液反应,溶液中有亚硫酸根离子(或亚硫酸根离子)生成,
故答案为:SO32-或HSO3-.
(2)碳与浓硫酸在加热条件下反应生成二氧化碳和二氧化硫,反应方程式为:C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
(3)反应Ⅱ中生成红色固体b为金属铜,说明原混合物中含有氧化铜,加入浓硫酸后溶液中生成了铜离子,再加入铁粉,铁粉与铜离子反应生成铜单质,反应的离子方程式为:Cu2++Fe═Cu+Fe2+,
故答案为:Cu2++Fe═Cu+Fe2+;
(4)气体甲和乙为二氧化碳和二氧化硫的混合气体,通过碳酸氢钠溶液时,二氧化硫与碳酸氢钠溶液反应,溶液中有亚硫酸根离子(或亚硫酸根离子)生成,
故答案为:SO32-或HSO3-.
点评:本题考查了未知物的检验,题目难度中等,注意明确常见元素单质及其化合物的性质,能够根据反应现象判断存在的物质,掌握常见化学方程式的书写方法.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目

 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O