题目内容
【题目】我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法错误的是( )

A.化合物Ⅰ能使酸性KMnO4溶液褪色
B.检验化合物Ⅱ中是否含化合物Ⅰ,可用Br2的CCl4溶液
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.化合物Ⅰ分子中含有5个手性碳原子
【答案】B
【解析】
A.化合物I中含C=C键,能被酸性高锰酸钾溶液氧化,使酸性KMnO4溶液褪色,故A正确;
B.两种化合物中均含C=C,均能使Br2的CCl4溶液褪色,所以用Br2的CCl4溶液不能检验化合物Ⅱ中是否含化合物Ⅰ,故B错误;
C.化合物Ⅱ中含-Cl、-OH、C=C,则一定条件下能发生取代、消去及加成反应,故C正确;
D.连有4个不同基团的碳原子为手性碳原子,化合物Ⅰ分子中有含有5个手性碳原子(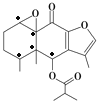 ),故D正确;
),故D正确;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

【题目】常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是
溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 4.0 |
A. 常温下,HSO3-的水解能力强于其电离能力
B. 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
C. Na2CO3 溶液中存在以下关系:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高



