题目内容
【题目】短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,r 溶于水是强酸,s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )

A.W 在周期表中所在族全是金属B.X 的最高价氧化物的水化物为强酸
C.Y 的氢化物常温常压下为气态D.1molZ 单质与氢氧化钠溶液反应转移 1mol 电子
【答案】D
【解析】
n 是元素Z 的单质,通常为黄绿色气体,为氯气,则Z为氯元素;q 的水溶液具有漂白性,则q为次氯酸;r 溶于水是强酸,可推知为盐酸; 由框图和对应的条件,可推知p为甲烷,m为水,则W、X、Y、Z 分别为H、C、O、Cl。
A.氢元素在第IA族,氢为非金属元素,故A错误;
B.X的最高价氧化物的水化物碳酸,碳酸为弱酸,故B错误;
C.Y为氧元素,其气态氢化物为水、双氧水,常温常压下均为液态,故C错误;
D.氯气与氢氧化钠发生歧化反应生成氯化钠和次氯酸钠,根据化合价变化可知,1mol氯气参加反应转移 1mol电子,故D正确;
综上所述,答案为D。

 名校课堂系列答案
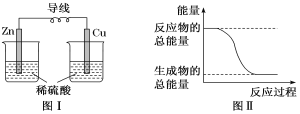
名校课堂系列答案【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D