题目内容
在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
B
【解析】
试题分析:由题可知: ,金属离子的物质的量为1mol,设金属离子所带的电荷数为
,金属离子的物质的量为1mol,设金属离子所带的电荷数为 ,则可得关系式:
,则可得关系式: ,解得
,解得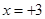 ,由此可知,该硫酸盐可为Al2(SO4)3
,且其物质的量为0.5mol,因此其浓度为
,由此可知,该硫酸盐可为Al2(SO4)3
,且其物质的量为0.5mol,因此其浓度为 ,故答案选B。
,故答案选B。
考点:溶液中离子浓度的计算
点评:对于溶液中涉及到的计算,应充分利用溶液的电中性,即“正负电荷总量相等”,可以减少计算量,提高正确率。

为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以回收高浓度的SO2并得到副产品化肥(NH4)2SO4和NH4HSO4。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[已知:(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0 |
(1)测定过程中有关反应的离子方程式为
_____________________________ 。
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为__________L。
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第______组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程。



