题目内容
(2009?松江区二模)下列说法正确的是( )
分析:A.加热HCl挥发,盐酸的浓度降低;
B.混合后所得硫酸的体积小于200m;
C.3 mol/L的BaCl2溶液中c(Cl-)是6mol/L,两溶液中氯离子的浓度不相同;
D.某温度KNO3的KNO3的溶解度是31.6 g/100g水,则该温度下50g水中溶解KNO3的质量为15.8g,为饱和溶液,根据质量分数计算.
B.混合后所得硫酸的体积小于200m;
C.3 mol/L的BaCl2溶液中c(Cl-)是6mol/L,两溶液中氯离子的浓度不相同;
D.某温度KNO3的KNO3的溶解度是31.6 g/100g水,则该温度下50g水中溶解KNO3的质量为15.8g,为饱和溶液,根据质量分数计算.
解答:解:A.加热HCl挥发,盐酸的浓度降低,故A错误;
B.微粒之间具有间隙,混合后所得硫酸的体积小于200mL,故所得溶液物质的量浓度大于1.5 mol/L,故B正确;
C.3mol?L-1的BaCl2溶液中氯离子浓度为6mol?L-1,3mol?L-1的KCl溶液中氯离子浓度为L3mol?L-1,混合后氯离子浓度,介于之间3mol?L-1~6mol?L-1,故C错误;
D.某温度KNO3的KNO3的溶解度是31.6 g/100g水,则该温度下50g水中溶解KNO3的质量为31.6g×
=15.8g,为饱和溶液,所得溶液的质量分数是
×100%=24.01%,故D错误;
故选B.
B.微粒之间具有间隙,混合后所得硫酸的体积小于200mL,故所得溶液物质的量浓度大于1.5 mol/L,故B正确;
C.3mol?L-1的BaCl2溶液中氯离子浓度为6mol?L-1,3mol?L-1的KCl溶液中氯离子浓度为L3mol?L-1,混合后氯离子浓度,介于之间3mol?L-1~6mol?L-1,故C错误;
D.某温度KNO3的KNO3的溶解度是31.6 g/100g水,则该温度下50g水中溶解KNO3的质量为31.6g×
| 50g |
| 100g |
| 15.8g |
| 15.8g+50g |
故选B.
点评:考查物质的量浓度与质量分数混合计算,难度中等,注意溶液混合体积不具备加合性,A为易错点,容易忽略溶质挥发性.

练习册系列答案
相关题目
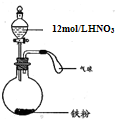 (2009?松江区二模)如图所示,向一定量的铁粉中加入一定体积12mol/L的硝酸,加热充分反应后,下列微粒在体系中可能大量存在的是( )
(2009?松江区二模)如图所示,向一定量的铁粉中加入一定体积12mol/L的硝酸,加热充分反应后,下列微粒在体系中可能大量存在的是( )