题目内容
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
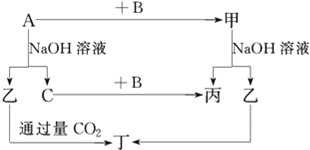
根据图示转化关系回答:
(1)写出下列物质的化学式。
A___,B___,乙___,丁___。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式___。
②甲与NaOH溶液反应的离子方程式___。
【答案】Al O2 NaAlO2 Al(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2OH-=2AlO2-+H2O
【解析】
A,B,C是单质,其中A是常见的活泼金属 ,B和C都是无色气体,常见金属单质中能与 NaOH溶液反应产生气体的只有Al,所以A 是Al,乙是NaAlO2,C是H2;甲是Al的化 物,可和NaOH溶液反应产生NaAlO2,可甲能是![]() ,则丙是
,则丙是![]() ,B即是
,B即是![]() ,根据
,根据![]() 得丁是
得丁是![]() ,丁加热后可生成水和氧化铝。
,丁加热后可生成水和氧化铝。
(1)由上述分析可知,A为Al,B为![]() ,乙是NaAlO2,丁是
,乙是NaAlO2,丁是![]() 故答案为:Al;
故答案为:Al;![]() ;
;![]() ;
;
(2) ①Al 与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②氧化铝与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目