题目内容
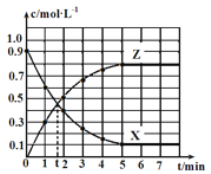
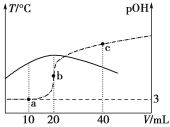
【题目】已知pOH=-lg c(OH-),向20 mL 0.1 mol·L-1的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法正确的是
A.稀硫酸的物质的量浓度为0.1 mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+)
D.a、b、c三点对应NH4+的水解平衡常数:Kh(c)>Kh(b)>Kh(a)
【答案】C
【解析】
20 mL0.1molL-1的氨水中滴加未知浓度的稀H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应时,放热最多,溶液的温度最高,所以硫酸的体积为20 mL时,恰好完全反应。
A.20 mL0.1 molL-1的氨水中含有一水合氨的物质的量为n(NH3H2O)=0.1 mol/L×0.02 L=0.002 mol,硫酸的体积为20 mL时,二者恰好完全反应,则消耗硫酸的物质的量为:0.002 mol×![]() =0.001 mol,所以该硫酸的物质的量浓度c(H2SO4)=
=0.001 mol,所以该硫酸的物质的量浓度c(H2SO4)=![]() =0.05 mol/L,A错误;
=0.05 mol/L,A错误;
B.当溶液中pH=pOH时,溶液为中性,此时溶质为硫酸铵和一水合氨,铵根离子的水解程度与氨水的电离程度相等,水的电离几乎没有影响,当氨水与硫酸恰好反应生成硫酸铵时,即b点时,铵根离子水解,促进了水的电离,此时水的电离程度最大,B错误;
C.a点加入10 mL硫酸,有一半的一水合氨被中和形成(NH4)2SO4,反应后溶质为一水合氨和硫酸铵,且一水合氨的浓度为硫酸铵浓度的2倍,根据电荷守恒可得:2c(SO42-)+c(OH-)= c(NH4+)+c(H+),根据物料守恒可得c(NH3·H2O)+c(NH4+)=4c(SO42-),二者结合可得:c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+),C正确;
D.由图可知,温度:b>a>c,温度升高,盐水解程度增大,水解平衡常数也增大,则a、b、c三点NH4+的水解平衡常数:Kh(b)>Kh(a)> Kh(c),D错误;
故合理选项是C。

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D