题目内容
下列实验对应的结论不正确的是
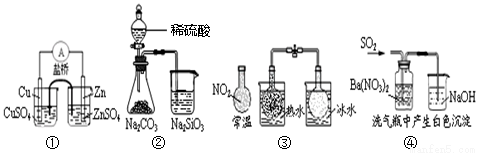
A.①能组成 Zn、Cu原电池 B.② 能证明非金属性:S>C>Si
Zn、Cu原电池 B.② 能证明非金属性:S>C>Si
C.③说明反应2NO2 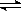 N2O4 △H<0 D.④ 白色沉淀为BaSO3
N2O4 △H<0 D.④ 白色沉淀为BaSO3
 名校课堂系列答案
名校课堂系列答案根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1 Na2CO3溶液的pH约为11;0.1 mol·L-1 NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
(1)浓硫酸与稀硫酸相比较,浓硫酸具有 。
(2)该反应的化学方程式为 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)Fe2(SO4)3的作用是_________________。
(4)得到的混合液可以用下列四种物质中的_______调节pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:
A.NaOH B.CuO C.CuCO3 D.Fe
(5)请根据以上内容,对这两个实验方案进行评价,填下表:(至少写一点)
实 验 (一) | 实 验 (二) | |
主要优 点 | 操作简便 | (1)原料充分转化为产品 (2)没有有害气体排放 |
主要缺 点 |


 不另加其他试剂就可以将它们分别开的是( )
不另加其他试剂就可以将它们分别开的是( ) Fe2++Ag+,且溶解度AgCl<Ag2SO4
Fe2++Ag+,且溶解度AgCl<Ag2SO4
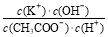 =1
=1
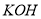 溶液的浓度不变
溶液的浓度不变 、SiO32- B.NH4+、OH-、Cl-、HCO3-
、SiO32- B.NH4+、OH-、Cl-、HCO3- 、CO32-
、CO32- 硫酸钡难溶于水,故硫酸钡属于弱电解质
硫酸钡难溶于水,故硫酸钡属于弱电解质