题目内容
18.对于反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,下列说法正确的是( )| A. | MnO2发生氧化反应,HCl发生还原反应 | |
| B. | 每反应掉4mol HCl转移2 mol电子 | |
| C. | 每生成1mol Cl2转移4 mol电子 | |
| D. | 反应中锰元素将电子转移给氯元素 |
分析 反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,结合电子转移相等解答.
解答 解:A.Mn元素化合价降低,被还原,MnO2为氧化剂发生还原反应,Cl元素化合价升高,被氧化,HCl为还原剂发生氧化反应,故A错误;
B.反应MnO2+4HCl═MnCl2+Cl2+2H2O中,每反应掉4mol HCl生成1 mol Cl2,则转移2 mol电子,故B正确;
C.Cl元素化合价由-1价升高到0价,则生成1 mol Cl2时有2 mol电子转移,故C错误;
D.Mn元素化合价降低得电子,Cl元素化合价升高失电子,则氯元素将电子转移给锰元素,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考高频考点和常见题型,注意从元素化合价的角度分析,难度不大.

练习册系列答案
相关题目
6.古诗词是古人为我们留下的宝贵精神财富.下列诗句不涉及氧化还原反应的是( )
| A. | 野火烧不尽,春风吹又生 | B. | 春蚕到死丝方尽,蜡炬成灰泪始干 | ||
| C. | 爆竹声中一岁除,春风送暖入屠苏 | D. | 粉身碎骨浑不怕,要留清自在人间 |
13.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出B的氢化物的结构式H-O-H
(2)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O
②D的氧化物与A、B、C形成的化合物的水溶液反应的离子方程式:Al2O3+2 OH-═AlO2-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出B的氢化物的结构式H-O-H
(2)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O
②D的氧化物与A、B、C形成的化合物的水溶液反应的离子方程式:Al2O3+2 OH-═AlO2-+H2O.
3.下列反应中,属于加成反应的是( )
| A. | CH4+C12$\stackrel{光}{→}$CH3Cl+HCl | B. | CH2=CH2+C12→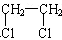 | ||
| C. | 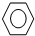 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | D. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O |
10.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 向某无色溶液中滴加BaCl2溶液,出现白色沉淀,说明溶液中存在SO42- | |
| C. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
7.下列反应中必须加入还原剂才能进行的是( )
| A. | H2SO4→SO2 | B. | Zn2+→Zn | C. | H2O→H2 | D. | CuO→CuCl2 |
8.100mL三种盐的混合溶液中含有0.2mol Na+,0.25mol Mg2+,0.4mol Cl-,则SO42-浓度为( )
| A. | 1.5 mol•L-1 | B. | 1 mol•L-1 | C. | 0.15 mol•L-1 | D. | 3 mol•L-1 |
 B(OH)4-+H+;
B(OH)4-+H+;