题目内容
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g)。
2C1NO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
(3)300℃时,2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
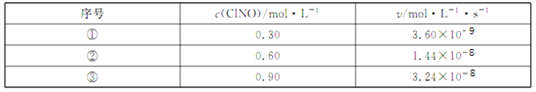
n =____________;k =__________________(注明单位)。
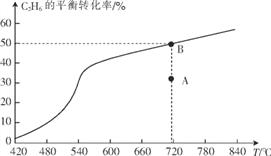
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
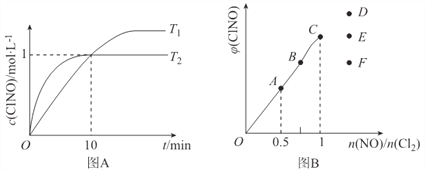
①该反应的ΔH ____________0(填“>”、“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min);
③T2时该反应的平衡常数K=____________。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
【答案】 K12/K2( 289-2a 2 4.0×10-8L/(mo1·s) < 0.1 2L/mol A D
【解析】(1)已知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
将①×2-②可得:2NO(g)+Cl2(g)![]() 2ClNO(g),因此平衡常数K3=K12/K2;
2ClNO(g),因此平衡常数K3=K12/K2;
(2)2NO(g)+C12(g)![]() 2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
(3)根据数据,结合正反应速率表达式为v正=k·cn(ClNO)可知,3.60×10-9mo1/(L·s)=k×(0.3mo1/L)n,1.44×10-8mo1/(L·s)=k×(0.6mo1/L)n,解得n=2,k=4.0×10-8L/(mo1·s);
(4)①根据图像,T2>T1,降低温度c(ClNO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;②反应开始到10min时,c(ClNO)=1mol/L,则v(ClNO)=![]() =0.1mol/(L·min),则NO的平均反应速率v(NO)=v(ClNO)=0.1mol/(L·min);③根据方程式可知
=0.1mol/(L·min),则NO的平均反应速率v(NO)=v(ClNO)=0.1mol/(L·min);③根据方程式可知
2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
T2时该反应的平衡常数K= =
=![]() =2;
=2;
(5)n(NO)/n(Cl2)的比值越小,NO的转化率越大,NO的转化率最大的是A点,根据曲线的变化趋势,当n(NO)/n(Cl2)=1.5,达到平衡状态ClNO的体积分数是D。