题目内容
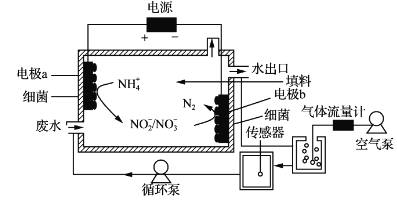
【题目】氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:下列说法正确的是( )

A.过程Ⅰ中发生的化学反应属于氧化还原反应
B.过程Ⅱ中NH4+→NO3-,每转化1molNH4+转移的电子数为8NA
C.过程Ⅲ中CH3OH→CO2,甲醇作氧化剂
D.过程Ⅲ中HNO3→N2,转移10mole-时可生成N211.2L(标准状况)
【答案】B
【解析】
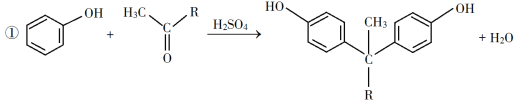
A. 过程Ⅰ中发生的化学反应为![]() ,没有化合价变化,属于非氧化还原反应,故A错误;
,没有化合价变化,属于非氧化还原反应,故A错误;
B. 过程Ⅱ中NH4+→NO3-,N元素化合价由-3升高为+5,每转化1molNH4+转移的电子数为8NA,故B正确;
C. 过程Ⅲ中CH3OH→CO2,C元素化合价升高,甲醇作还原剂,故C错误;
D. 过程Ⅲ中HNO3→N2,N元素化合价由+5降低为0,转移10mole-时可生成1molN2,在标准状况下的体积是22.4 L,故D错误;
选B。

【题目】FTO导电玻璃为抄杂氟的SnO2透明导电玻璃,r泛用于液晶显示屏,薄膜太阳能电池基底等方面,SnCl4可用于制作FTO导电玻璃。实验室可用熔融的锡与Cl2反应制备SnCl4,此反应放热,生成的SnCl4易水解生成SnO2XH2O。回答下列问题:

有关物理性质如下表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 231.9 | 2260 |
SnCl4 | 无色液体 | -33 | 114 |
SnCl2 | 无色晶体 | 246 | 652 |
(1)将上述装置用玻璃管连接,组装成一套制备SnCl4的实验装置(每个装置最多使用一次),正确的顺序是:(填各接口的字母)
B →____ →____ →____ →____→_____N→A→____ →___→____→____;
(2)Ⅲ处中应选用的冷凝管为_______(填选项字母);

(3)检查装置气密性并装好药晶后,应先______待出现______再点燃I处的酒精灯,否则会有副反应发生:①___________________.②_________________(用化学方程式表示);
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为减少产晶中SnCl2的量,可采取的措施是_______________________________、____________________________________;
(5)已知Fe3++Sn2+—Fe2++Sn4+(未配平)。准确称取样品mg于饶杯中。用少量浓盐酸溶解。加入过量的氧化铁溶液,再加水稀释,配制成250 mL.溶液。取25.00 mL于锥形瓶中。用0.1000 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗标准液15.00 mL.则产品中SnCl2的含量W _______% (用含m的代数式表示)。