题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
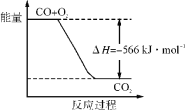
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1,
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1;
SO2通常在NO2的存在下,进一步被氧化,生成SO3。写出NO2和SO2反应的热化学方程式为________________________________。
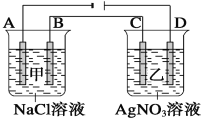
(2)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的_______(填“正”或“负”)极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
(3)常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____________________________________(写出主要反应的离子方程式),该溶液中c(Na+)_________ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”);
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)- c(H2SO3)= _________ mol/L(填写准确数值)。
【答案】 NO2(g)+SO2(g)SO3(g)+ NO(g)△H= -42 kJmol-1 负 硫酸 SO32--2e- + H2O =SO42-+ 2H+ SO32- + H2O HSO3- + OH - > 9.9×10-7
【解析】(1)根据盖斯定律来求解,正反应如果是吸热反应,温度越高K值越大;
(2)在图中由于Na+向a极区域移动,根据同种电荷相互排斥,异种电荷相互吸引的原则,a要连接电源的负极,b要连接电源的正极,在阳极上SO32-变为SO42-;
(3)①溶液中SO32-水解,导致溶液显碱性,然后根据电荷守恒分析;②常温下,亚硫酸氢钠呈酸性,说明亚硫酸氢根离子的电离程度大于水解程度,根据物料守恒和电荷守恒计算。
(1)①根据盖斯定律来求解,2NO(g)+O2(g)2NO2(g)△H=-112kJmol-1 ①;2SO2(g)+O2(g)2SO3(g)△H=-196kJmol-1②,根据盖斯定律,将(②-①)÷2得:NO2(g)+SO2(g)=SO3(g)+NO(g)△H=-42kJmol-1,故答案为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-42 kJmol-1;
(2)①在图中由于Na+向a极区域移动,根据同种电荷相互排斥,异种电荷相互吸引的原则,a要连接电源的负极,b要连接电源的正极,在阳极上SO32-变为SO42-,C口流出的物质是硫酸,故答案为:负;硫酸;
②在阳极上SO32-变为SO42-,SO32-放电的电极反应式为:SO32-+H2O=SO42-+2H+,故答案为:SO32-+H2O=SO42-+2H+;
(3)①溶液中SO32-水解:SO32-+H2OHSO3-+OH-,破坏水的电离平衡,导致溶液显碱性,根据电荷守恒,溶液中c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),因为c(H+)<c(OH-),故c(Na+)>2c(SO32-)+c(HSO3-),故答案为:SO32-+H2OHSO3-+OH-;>;
②常温下,亚硫酸氢钠呈酸性,说明亚硫酸氢根离子的电离程度大于水解程度,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)①,根据电荷守恒得c(Na+)+c(H+) =c(OH-)+c(HSO3-)+2c(SO32-)②,将方程式①代入②得,c(H2SO3)+c(H+) =c(OH-)+c(SO32-),所以c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=(10-6-10-8)molL-1 =9.9×10-7molL-1,故答案为:9.9×10-7mol。

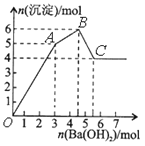
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-