题目内容
14.(1)乙烷的电子式为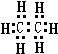 ,分子式为CmH20的烷烃中m为9,分子式为C8Hn的烷烃中n为18,与CO2 密度(同温同压)相同的烷烃分子式为C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
,分子式为CmH20的烷烃中m为9,分子式为C8Hn的烷烃中n为18,与CO2 密度(同温同压)相同的烷烃分子式为C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.(2)若CH4 、C2H6、C3H8 、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是CH4.
分析 (1)乙烷的分子式为C2H6,根据原子成键特点写出电子式,根据烷烃的通式CxH2x+2来计算m、n,与CO2 密度(同温同压)相同的烷烃,其相对分子质量应该和二氧化碳的相等,烃燃烧耗氧量取决于C、H原子个数的大小,1mol烃的耗氧量=C原子个数+$\frac{氢原子个数}{4}$;
(2)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多.
解答 解:(1)因碳原子的最外层有4个电子,氢原子最外层1个电子,一个碳原子形成4对共用电子对,一个氢原子形成一对共用电子对,所以电子式为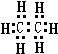 ;据烷烃的通式CxH2x+2,分子式为CmH20的烷烃中m为9,分子式为C8Hn的烷烃中n=18,与CO2 密度(同温同压)相同的烷烃分,其相对分子质量应该和二氧化碳的相等,即为44,分子式为C3H8,若上述四种烃各为1mol,1mol烃的耗氧量=C原子个数+$\frac{氢原子个数}{4}$;分别是1molC2H6、C9H20、C8H18、C3H8在足量O2中燃烧,消耗O2分别是:3.5mol、14mol、12.5mol、5mol,所以耗O2最多的是C9H20,
;据烷烃的通式CxH2x+2,分子式为CmH20的烷烃中m为9,分子式为C8Hn的烷烃中n=18,与CO2 密度(同温同压)相同的烷烃分,其相对分子质量应该和二氧化碳的相等,即为44,分子式为C3H8,若上述四种烃各为1mol,1mol烃的耗氧量=C原子个数+$\frac{氢原子个数}{4}$;分别是1molC2H6、C9H20、C8H18、C3H8在足量O2中燃烧,消耗O2分别是:3.5mol、14mol、12.5mol、5mol,所以耗O2最多的是C9H20,
故答案为: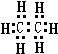 ;9;18;C3H8;C9H20;
;9;18;C3H8;C9H20;
(2)CH4 、C2H6、C3H8 、C4H10的H%大小为:CH4>C2H6>C3H8>C4H10,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,消耗O2最多的是CH4,故答案为:CH4.
点评 本题考查烃燃烧耗氧量以及电子式的书写、烷烃的通式的应用等问题,难度不大,注意对规律的理解与掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 8个中子的碳原子的核素符号:12C | B. | 氢氧化钠的电子式: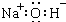 | ||
| C. | Cl-离子的结构示意图: | D. | CH4分子的比例模型: |
2.如图是四位同学学习了元素周期表后,对这节内容的认识,你认为不正确的是( )


| A. | A | B. | B | C. | C | D. | D |
9.下列各种转化中,属于生物质能的化学转化的是( )
| A. | 石油燃烧 | |
| B. | 木材燃烧 | |
| C. | 在汽化炉内加热固体生物质,同时通入空气或水蒸气,或者隔绝空气高温加热生物质,使之发生复杂的化学反应产生可燃气体 | |
| D. | 杂草和人畜粪便加入沼气发酵池中生成沼气 |
19.下列“油”中属于酯类的是( )
①豆油 ②酱油 ③牛油 ④甘油 ⑤重油 ⑥硝化甘油.
①豆油 ②酱油 ③牛油 ④甘油 ⑤重油 ⑥硝化甘油.
| A. | ①③⑥ | B. | ②④⑤ | C. | ①③④ | D. | ③⑤⑥ |
3.三聚氰胺又名蛋白精[分子式:C3N3(NH2)3,相对分子质量:126]是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患.有关三聚氰胺的下列说法正确的是( )
| A. | 2.52 g三聚氰胺含氮原子数目为0.12NA | |
| B. | 标准状况下1 mol的三聚氰胺的体积为22.4 L | |
| C. | 三聚氰胺含氮量约为10% | |
| D. | 三聚氰胺的摩尔质量为126 |
4.若1mol某气态烃CxHy完全燃烧,需用5mol O2,则(x+y )的值( )
| A. | 9 | B. | 10 | C. | 11 | D. | 12 |



 .
. .
.