题目内容
实验室配制500 mL 0.1 mol·L-1的Na2CO3溶液,请回答下列问题。
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1 g以下用游码),天平平衡时,则实际称量的Na2CO3·10H2O晶体 g。
(3)用托盘天平和小烧杯称出Na2CO3·10H2O的质量,其正确操作顺序的标号为(操作可以重复)_______________。
E.记录称量结果
(4)下列操作对配得的溶液无影响的是 (填序号);会使所配溶液浓度偏大的是 (填序号)。
①在烧杯内溶解溶质,搅拌时不慎溅出少量溶液。
②容量瓶未烘干就用来配制溶液。
③定容时俯视刻度线。
④定容时仰视刻度线。
⑤定容时不小心使少量蒸馏水流出瓶外。
⑥将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出。
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1 g以下用游码),天平平衡时,则实际称量的Na2CO3·10H2O晶体 g。
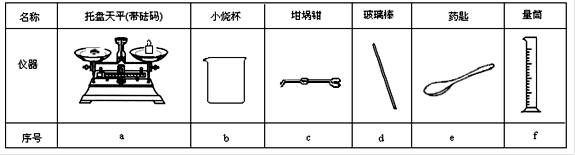
(3)用托盘天平和小烧杯称出Na2CO3·10H2O的质量,其正确操作顺序的标号为(操作可以重复)_______________。
| A.调整零点 |
| B.将游码移至刻度尺的零刻度处,将砝码放回砝码盒内 |
| C.将碳酸钠晶体放入小烧杯中称量 |
| D.称量空的小烧杯 |
(4)下列操作对配得的溶液无影响的是 (填序号);会使所配溶液浓度偏大的是 (填序号)。
①在烧杯内溶解溶质,搅拌时不慎溅出少量溶液。
②容量瓶未烘干就用来配制溶液。
③定容时俯视刻度线。
④定容时仰视刻度线。
⑤定容时不小心使少量蒸馏水流出瓶外。
⑥将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出。
(1)14.3g。 (2)13.7g。 (3)ADECEB (4)2.5.6(填序号);3(填序号)
考查一定物质的量浓度溶液的配制及有关误差分析。
(1)500 mL 0.1 mol·L-1的Na2CO3溶液中碳酸钠的物质的量是0.05mol,所以需要Na2CO3·10H2O晶体的质量是0.05mol×286g/mol=14.3g。
(2)由于托盘天平中,左盘的质量总是等于右盘的质量和游码的质量之和,所以当药品放在天平右盘上,砝码放在天平左盘上时,物体的实际质量是14.0g-0.3g=13.7g。
(3)根据配制的原理及要求可知,正确的操作顺序是ADECEB。
(4)根据c=b/V可知,如果在烧杯内溶解溶质,搅拌时不慎溅出少量溶液,则溶质减少,浓度偏小;容量瓶不需要烘干,因此选项②无影响;定容时俯视刻度线,则容量瓶中溶液的体积减少,浓度偏高;定容时仰视刻度线,则容量瓶中溶液的体积增加,浓度偏小;定容时不小心使少量蒸馏水流出瓶外,对实验结果不影响;同样将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出时,也不会影响实验结果。
(1)500 mL 0.1 mol·L-1的Na2CO3溶液中碳酸钠的物质的量是0.05mol,所以需要Na2CO3·10H2O晶体的质量是0.05mol×286g/mol=14.3g。
(2)由于托盘天平中,左盘的质量总是等于右盘的质量和游码的质量之和,所以当药品放在天平右盘上,砝码放在天平左盘上时,物体的实际质量是14.0g-0.3g=13.7g。
(3)根据配制的原理及要求可知,正确的操作顺序是ADECEB。
(4)根据c=b/V可知,如果在烧杯内溶解溶质,搅拌时不慎溅出少量溶液,则溶质减少,浓度偏小;容量瓶不需要烘干,因此选项②无影响;定容时俯视刻度线,则容量瓶中溶液的体积减少,浓度偏高;定容时仰视刻度线,则容量瓶中溶液的体积增加,浓度偏小;定容时不小心使少量蒸馏水流出瓶外,对实验结果不影响;同样将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出时,也不会影响实验结果。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
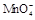 在酸性环境下的还原产物是
在酸性环境下的还原产物是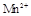 ;②草酸是二元弱酸。
;②草酸是二元弱酸。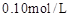 的草酸溶液
的草酸溶液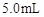 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。 固体
固体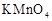 溶液
溶液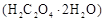 样品
样品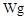 ;配制成
;配制成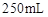 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答: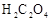 溶液与酸性
溶液与酸性