题目内容
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液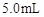 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体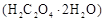 样品
样品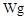 ;配制成
;配制成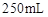 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述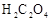 溶液与酸性
溶液与酸性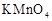 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
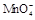 在酸性环境下的还原产物是
在酸性环境下的还原产物是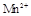 ;②草酸是二元弱酸。
;②草酸是二元弱酸。Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入
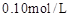 的草酸溶液
的草酸溶液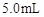 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |  固体 固体 | 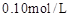 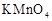 溶液 溶液 | 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体
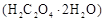 样品
样品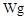 ;配制成
;配制成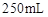 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述
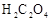 溶液与酸性
溶液与酸性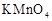 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
(13分)Ⅰ.①稀硫酸可使上述反应速率加快;②升高温度,反应速率加快;
③Mn2+作该反应的催化剂,可加快反应速率。(每个结论2分,其它合理答案均给分)(6分)
Ⅱ.(1)酸式滴定管(2分)
(2)5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑(3分)
(3)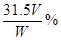 (其它合理表达式均给分)(4分)
(其它合理表达式均给分)(4分)
③Mn2+作该反应的催化剂,可加快反应速率。(每个结论2分,其它合理答案均给分)(6分)
Ⅱ.(1)酸式滴定管(2分)
(2)5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑(3分)
(3)
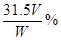 (其它合理表达式均给分)(4分)
(其它合理表达式均给分)(4分)Ⅰ.根据反应中改变的条件及褪色时间长短可知,可以得出的结论有.①稀硫酸可使上述反应速率加快;②升高温度,反应速率加快;③Mn2+作该反应的催化剂,可加快反应速率。
Ⅱ.(1)滴定实验中小于滴定管,而酸性高锰酸钾溶液需要放在酸式滴定管中。
(2)草酸的氧化产物是CO2,而高锰酸钾的还原产物是硫酸锰,所以根据电子的得失守恒及质量守恒定律可知,该反应的方程式是5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑。
(3)稀释高锰酸钾的物质的量是0.0001Vmol,所以根据方程式可知,草酸的物质的量是0.00025Vmol,则原溶液中草酸的物质的量是0.00025Vmol×10=0.0025Vmol。因此草酸晶体的纯度为 。
。
Ⅱ.(1)滴定实验中小于滴定管,而酸性高锰酸钾溶液需要放在酸式滴定管中。
(2)草酸的氧化产物是CO2,而高锰酸钾的还原产物是硫酸锰,所以根据电子的得失守恒及质量守恒定律可知,该反应的方程式是5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑。
(3)稀释高锰酸钾的物质的量是0.0001Vmol,所以根据方程式可知,草酸的物质的量是0.00025Vmol,则原溶液中草酸的物质的量是0.00025Vmol×10=0.0025Vmol。因此草酸晶体的纯度为
 。
。
练习册系列答案
相关题目