题目内容
(2011?怀柔区模拟)合成氨工业生产条件:催化剂:铁触媒,温度:400~500℃,压强:30~50MPa.每生成0.1molNH3放热4.61kJ.
请回答:
(1)工业合成氨反应的热化学方程式
(2)铁触媒是以FeO和Fe2O3为主要成分的氧化物.某铁触媒中n(Fe2+):n(Fe3+)=1:1,则n(Fe):n(O)=
(3)某同学为探究某铁触媒的成分,用适量稀硝酸溶解少量样品,取少许所得溶液滴加KSCN出现红色,由此确定该铁触媒中铁为+3价,你认为该结论
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液制取新型燃料电池,同时达到固氮作用.该电池的正极反应式为
请回答:
(1)工业合成氨反应的热化学方程式
N2(g)+3H2(g)
2NH3(g)△H=-92.2kJ/mol
| 催化剂 |
| 高温高压 |
N2(g)+3H2(g)
2NH3(g)△H=-92.2kJ/mol
生产中采用400~500℃的高温,原因之一是考虑催化剂的活性,原因之二是| 催化剂 |
| 高温高压 |
提高反应速率,缩短达到平衡的时间
提高反应速率,缩短达到平衡的时间
(2)铁触媒是以FeO和Fe2O3为主要成分的氧化物.某铁触媒中n(Fe2+):n(Fe3+)=1:1,则n(Fe):n(O)=
4:5
4:5
.实验测定,当n(Fe2+):n(Fe3+)=1:2时催化活性最高.Fe2O3中加适量碳粉可制备这种催化活性最高的铁触媒:2Fe2O3+C=4FeO+CO2↑,理论上,240g Fe2O3中需要加入碳粉3
3
g可以制备这种催化剂.(3)某同学为探究某铁触媒的成分,用适量稀硝酸溶解少量样品,取少许所得溶液滴加KSCN出现红色,由此确定该铁触媒中铁为+3价,你认为该结论
不合理
不合理
(填合理或不合理),理由:由于硝酸会氧化其中可能存在的二价铁,结果只能判断样品溶解于硝酸后中存在三价铁而不能确定原样品中铁元素的价态
由于硝酸会氧化其中可能存在的二价铁,结果只能判断样品溶解于硝酸后中存在三价铁而不能确定原样品中铁元素的价态
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液制取新型燃料电池,同时达到固氮作用.该电池的正极反应式为
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
.分析:(1)由外界条件对化学平衡以及化学反应速率的影响分析;
(2)根据化合价代数和为0以及反应的化学方程式计算;
(3)硝酸具有强氧化性,能将铁氧化为三价铁;
(4)N2在正极发生还原反应生成NH4+,以此书写电极反应式.
(2)根据化合价代数和为0以及反应的化学方程式计算;
(3)硝酸具有强氧化性,能将铁氧化为三价铁;
(4)N2在正极发生还原反应生成NH4+,以此书写电极反应式.
解答:解:(1)每生成0.1molNH3放热4.61kJ,则反应的热化学方程式为N2(g)+3H2(g)
2NH3(g)△H=-92.2kJ/mol,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间,
故答案为:N2(g)+3H2(g)
2NH3(g)△H=-92.2kJ/mol;提高反应速率,缩短达到平衡的时间;
(2)铁触媒中n(Fe2+):n(Fe3+)=1:1,根据化合物化合价代数和为0可知,n(Fe):n(O)=2:2.5=4:5,
n(Fe2O3)=
=1.5mol,
当n(Fe2+):n(Fe3+)=1:2时活性最高,
则应生成1molFeO,
2Fe2O3+C=4FeO+CO2↑,
12g 4mol
m 1mol
m=3g,
故答案为:4:5;3;
(3)硝酸具有强氧化性,硝酸会氧化其中可能存在的二价铁,只能判断样品溶解于硝酸后中存在三价铁而不能确定原样品中铁元素的价态,所以加入硝酸溶解不合理,应加入非氧化性酸溶解铁触媒,
故答案为:不合理;由于硝酸会氧化其中可能存在的二价铁,结果只能判断样品溶解于硝酸后中存在三价铁而不能确定原样品中铁元素的价态;
(4)N2在正极发生还原反应生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,故答案为:N2+6e-+8H+=2NH4+.
| 催化剂 |
| 高温高压 |
故答案为:N2(g)+3H2(g)
| 催化剂 |
| 高温高压 |
(2)铁触媒中n(Fe2+):n(Fe3+)=1:1,根据化合物化合价代数和为0可知,n(Fe):n(O)=2:2.5=4:5,
n(Fe2O3)=
| 240g |
| 160g/mol |
当n(Fe2+):n(Fe3+)=1:2时活性最高,
则应生成1molFeO,
2Fe2O3+C=4FeO+CO2↑,
12g 4mol
m 1mol
m=3g,
故答案为:4:5;3;
(3)硝酸具有强氧化性,硝酸会氧化其中可能存在的二价铁,只能判断样品溶解于硝酸后中存在三价铁而不能确定原样品中铁元素的价态,所以加入硝酸溶解不合理,应加入非氧化性酸溶解铁触媒,
故答案为:不合理;由于硝酸会氧化其中可能存在的二价铁,结果只能判断样品溶解于硝酸后中存在三价铁而不能确定原样品中铁元素的价态;
(4)N2在正极发生还原反应生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,故答案为:N2+6e-+8H+=2NH4+.
点评:本题考查氨的合成,题目难度中等,本题易错点为(2),注意把握计算的角度,答题时仔细体会.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目

 :
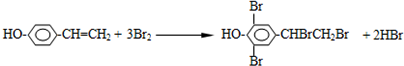
:


 4C(l)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( )
4C(l)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( ) (2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
(2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁