题目内容
(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a. 6CO2+6H2O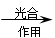 C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)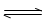 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
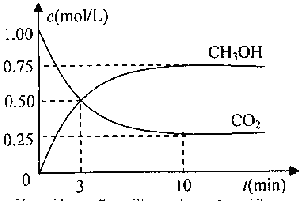
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
(II)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
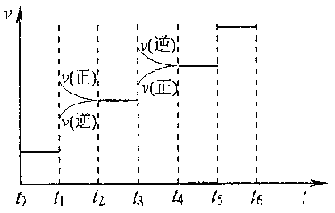
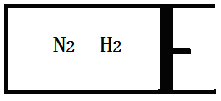
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为 。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a. 6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2b.CO2+3H2
 CH3OH+H2O
CH3OH+H2Oc.CO2+CH4
 CH3COOH
CH3COOHd.2CO2+6H2
 CH2=CH2+4H2O
CH2=CH2+4H2O以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
N2(g)+3H2(g)
 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。


图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为 。
(I)(1)保护臭氧层
(2)a,c。
(3)①0.225
解析:①从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CH3OH)=
②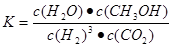 ,减小
,减小
③CD
(II)①加压,t2~t3 ②75%
(2)a,c。
(3)①0.225
解析:①从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CH3OH)=

②
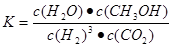 ,减小
,减小③CD
(II)①加压,t2~t3 ②75%
(I)(1)保护臭氧层
由于氟利昂化学性质稳定,具有不燃、低毒、介电常数低、临界温度高、易液化等特性,因而广泛用作冷冻设备和空气调节装置的制冷剂。由于氟利昂可能破坏大气臭氧层,已限制使用。臭氧层被大量损耗后,吸收紫外线辐射的能力大大减弱,导致到达地球表面的紫外线明显增加,给人类健康和生态环境带来多方面的危害。
(2)a,c。
a最节能,利用光合作用,将光能转化为化学能;C,是化合反应,原子利用率100%。
(3)①0.225
②
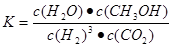 ,减小
,减小解析:②该反应的平衡常数表达式为
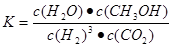 ,该反应为放热反应,升高温度,平衡逆向移动,平衡常数的数值将减小(填“增大”、“减小”或“不变”)。
,该反应为放热反应,升高温度,平衡逆向移动,平衡常数的数值将减小(填“增大”、“减小”或“不变”)。③CD
解析:③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小
B.充入He(g),使体系压强增大,但体积不变,平衡不移动,n(CH3OH)/n(CO2)不变。
C.将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)/n(CO2)增大
D.再充入1molCO2和3molH2,相当于加压,平衡正向移动,n(CH3OH)/n(CO2)增大。
(II)①加压,t2~t3 ②75%
解析:①从图看出正、逆反应速率均增大,正反应速率变化大于逆反应速率,平衡正向移动,加压符合。
其中表示平衡混合物中NH3含量最高的一段时间是t2~t3,t3~t4时平衡逆向移动,NH3含量变小,t4~t5平衡不移动,NH3含量与前一段时间相同。
②可逆反应: N2 + 3H2 = 2NH3
起始: a 3a
平衡: a-0.5a 3a-1.5a a
起始2: a 3a 2a
折算相当于:2a 6a 0
平衡: 2a-1a 6a-3a 2a
由于是容积可变的反应容器,反应物物质的量为原来的2倍,混合气的体积也就为原来的2倍(原题应该说是恒压下比较好),浓度与原来相等,达到等效平衡。
混合气中H2的体积分数与原平衡相等,即(3a-1.5a)÷(a-0.5a+3a-1.5a+1a)×100%=50%。
(原答案有误)

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
 C6H12O6+6O2可知碳是农作物生长的必需元素之一。关于用二氧化碳生产肥料的评价正确的是
C6H12O6+6O2可知碳是农作物生长的必需元素之一。关于用二氧化碳生产肥料的评价正确的是
 工成涂料或汽油
工成涂料或汽油