题目内容
10.写出下列反应的离子方程式:硫酸钠和硝酸钡SO42-+Ba2+═BaSO4↓;碳酸钠与足量的盐酸CO32-+2H+═H2O+CO2↑.分析 硫酸钠与硝酸钡反应生成硫酸钡沉淀和硝酸钠;碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,以此来解答.
解答 解:硫酸钠与硝酸钡反应生成硫酸钡沉淀和硝酸钠,离子反应为SO42-+Ba2+═BaSO4↓;碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,离子反应为CO32-+2H+═H2O+CO2↑,故答案为:SO42-+Ba2+═BaSO4↓;CO32-+2H+═H2O+CO2↑.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
18.只用一种试剂即可鉴别氯化镁、氯化铁、氯化亚铁、氯化铵、氯化钠这五种溶液,该试剂是( )
| A. | KSCN | B. | BaCl2 | C. | HCl | D. | NaOH |
5.PH3是一种无色、有剧毒的气体,其分子结构和NH3相似,下列判断正确的是( )
| A. | N-H的键长比P-H的键长短,所以PH3的沸点比NH3低 | |
| B. | PH3分子的立体构型是三角锥形,与NH3互为等电子体 | |
| C. | PH3分子是极性分子,极易溶于水,因为它与水分子间存在氢键 | |
| D. | NH3比PH3稳定,因为NH3分子间存在氢键 |
15.以下实验能获得成功的是( )
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 可用甲烷与氯气光照的方法制取纯净的一氯甲烷 | |
| C. | 用紫色石蕊试液检验苯酚溶液的弱酸性 | |
| D. | 可以用苯、浓硝酸和浓硫酸水浴加热制硝基苯 |
19.已知室温下某溶液由水电离出的氢离子浓度是10-12mol/L,在此溶液中肯定能大量共存的离子组是( )
| A. | NO3-、NH4+、K+、SO42- | B. | CO32-、Cl-、Na+、K+ | ||
| C. | Mg2+、NO3-、C1-、Fe2+ | D. | K+、Na+、NO3-、SO42- |
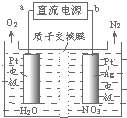 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.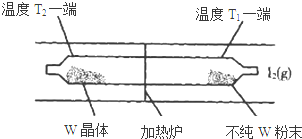 利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.