题目内容
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式 ;
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
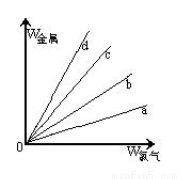
(3)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的 。
(1)MnO2 + 2Cl-+ 4H+ Mn2+ + Cl2↑+ 2H2O( 2分)
Mn2+ + Cl2↑+ 2H2O( 2分)
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (2分) (3)b (2分) Na(2分)
【解析】
试题分析:(1)实验室制取氯气的化学方程式为MnO2 + 2Cl-+ 4H+ Mn2+ + Cl2↑+ 2H2O。
Mn2+ + Cl2↑+ 2H2O。
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(3)Cl2与四种金属反应的均为氧化还原反应,在横坐标上取一点作一条垂直于横坐标的直线,分别与a、b、c、d四条直线的交点即为四种金属与等质量Cl2反应时所需的质量。假设这一点的体积为标准状况下的22.4L,此时金属均转移2mol电子,则消耗四种金属的质量分别为:WNa=46g、WCu=64g、WAl=18g、WFe=37.3g,即等质量氯气消耗四种金属的质量是WCu>WNa>WFe>WAl,故a、b、c、d分别代表Al、Fe、Na、Cu与氯气的反应,即代表铁与Cl2反应的直线是b;如果横轴表示消耗掉的硫的质量,则根据方程式2Na+S=Na2S、2Al+3S=Al2S3、Fe+S=FeS、2Cu+S=Cu2S,假设消耗硫都是1mol,则需要金属的质量分别为:WNa=46g、WCu=128g、WAl=18g、WFe=56g,即等质量氯气消耗四种金属的质量是WCu>WFe>WNa>WAl,则b表示的是四种金属中的钠。
考点:考查氯气、漂白粉制备原理以及氧化还原反应的有关计算