题目内容
【题目】如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( ) 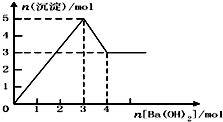
A.NH4Al(SO4)2
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
【答案】C
【解析】解:A.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,故NH4Al(SO4)2为2mol,加入3mol氢氧化钡可以生成硫酸钡3mol,n(Al3+):n(OH﹣)=2mol:6mol=1:3,发生反应Al3++3OH﹣═Al(OH)3↓,可以得到2molAl(OH)3 , 沉淀为3mol+2mol=5mol,再加入1mol氢氧化钡,再生成1mol硫酸钡沉淀,同时2molOH﹣与NH4+ , 此时的沉淀量为5mol+1mol=6mol:故A错误; B.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,故KAl(SO4)2为2mol,加入3mol氢氧化钡可以生成硫酸钡3mol,n(Al3+):n(OH﹣)=2mol:6mol=1:3,发生反应Al3++3OH﹣═Al(OH)3↓,可以得到2molAl(OH)3 , 沉淀为3mol+2mol=5mol,再加入1mol氢氧化钡,再生成1mol硫酸钡沉淀,同时2molOH﹣使2molAl(OH)3溶解,此时的沉淀量为5mol+1mol﹣2mol=4nol,故B错误;
C.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡沉,可以生成硫酸钡3mol,n(Al3+):n(OH﹣)=2mol:6mol=1:3,发生反应Al3++3OH﹣═Al(OH)3↓,可以得到2molAl(OH)3 , 沉淀为3mol+2mol=5mol,故C正确;
D.偏铝酸钠与氢氧化钡不反应,不能产生沉淀,故D错误;
故选:C.
A.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,结合加入3mol氢氧化钡沉淀最大判断;
B.由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,结合加入3mol氢氧化钡沉淀最大判断;
C.先发生反应Ba2++SO42﹣=BaSO4↓、Al3++3OH﹣═Al(OH)3↓,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH﹣=AlO2﹣+2H2O可知沉淀中Al(OH)3为2mol,结合加入3mol氢氧化钡沉淀最大判断;
D.偏铝酸钠与氢氧化钡不反应.
