题目内容
12.下列离子组在指定溶液中能大量共存的是( )| A. | 强酸溶液中:K+、Fe2+、MnO-4、SO2-4 | |
| B. | 滴加石蕊试液显红色的溶液中:Fe3+、NH+4、C1-、SCN- | |
| C. | 既能溶解A1(OH)3又能溶解H2SiO3的溶液中:Na+、CO2-3、SO2-3、NO-3 | |
| D. | 在含有大量HCO-3的溶液中:K+、Na+、OH-、Br - |
分析 A.强酸溶液中离子之间发生氧化还原反应;
B.滴加石蕊试液显红色的溶液,显酸性,离子之间结合生成络离子;
C.既能溶解A1(OH)3又能溶解H2SiO3的溶液,为强碱溶液;
D.离子之间结合生成水.
解答 解:A.强酸溶液中H+、Fe2+、MnO4-发生氧化还原反应,不能大量共存,故A错误;
B.滴加石蕊试液显红色的溶液,显酸性,Fe3+、SCN-结合生成络离子,不能大量共存,故B错误;
C.既能溶解A1(OH)3又能溶解H2SiO3的溶液,为强碱溶液,该组离子之间不反应,可大量共存,故C正确;
D.HCO3-、OH-结合生成水和碳酸根离子,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、络合反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
2.在某一化学反应中,反应物A的浓度在2s内由1.0mol/L变成0.2mol/L,则在这2s内它的平均反应速率为( )
| A. | 0.08mol/(L•s) | B. | 0.8mol/(L•s) | C. | 0.4mol/(L•s) | D. | 0.04mol/L |
3.对于如图所示铜-锌原电池,以下说法不正确的是( )
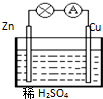

| A. | 铜为正极 | |
| B. | 它是一种把化学能转化为电能的装置 | |
| C. | 锌片上发生氧化反应 | |
| D. | 铜片向外电路提供电子,锌片从外电路得到电子 |
20.欲配制含0.5molNaCl、0.16molKCl、0.24molK2SO4和1LH2O的植物营养液,现用NaCl、KCl、Na2SO4和1LH2O为原料配得相同组成的营养液,需三种固体的物质的量为( )
| A. | NaCl 0.32mol; KCl 0.01mol; Na2SO4 0.12mol | |
| B. | NaCl 0.50mol; KCl 0.16mol; Na2SO4 0.24mol | |
| C. | NaCl 0.66mol; KCl 0.48mol; Na2SO4 0.25mol | |
| D. | NaCl 0.02mol; KCl 0.64mol; Na2SO4 0.24mol |
7.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
C$→_{高温}^{CuO}$CO2$\stackrel{H_{2}O}{→}$H2CO3$\stackrel{Ca(OH)_{2}}{→}$CaCO3$\stackrel{高温}{→}$CO2.
C$→_{高温}^{CuO}$CO2$\stackrel{H_{2}O}{→}$H2CO3$\stackrel{Ca(OH)_{2}}{→}$CaCO3$\stackrel{高温}{→}$CO2.
| A. | 化合 置换 分解 复分解 | B. | 置换 复分解 化合 分解 | ||
| C. | 置换 化合 复分解 分解 | D. | 置换 化合 分解 复分解 |
17.能正确表示下列反应的离子方程式的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 向氯化铝溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氧化铜与硫酸反应:Cu2++SO42-═CuSO4 |
2.关于氢键,下列说法正确的是( )
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 氯化钠易溶于水是因为形成了氢键 | |
| C. | 氨易液化与氨分子间存在氢键无关 | |
| D. | 甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键 |