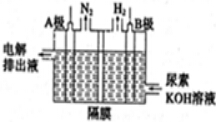
题目内容
10.用双线桥法标出下列反应中电子转移的方向和数目:2Al+6HCl═2AlCl3+3H2↑此反应中,还原剂是Al,氧化剂是HCl;Al元素被氧化.由此可知,氧化还原反应的实质是反应过程中有电子转移.根据你的理解再写一个常见的氧化还原反应的化学方程式:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
分析 2Al+6HCl═2AlCl3+3H2↑中,H元素的化合价降低被还原,则HCl为氧化剂,Al元素的化合价升高被氧化,则Al为还原剂,该反应中转移6e-;
解答 解:H元素的化合价由+1降低为0,Al元素的化合价由0升高为+3价,则HCl为氧化剂,H元素被还原,Al为还原剂,Al元素被氧化,该反应中2molAl参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为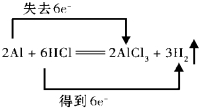 ,则氧化还原反应的实质是反应过程中有电子转移,常见的氧化还原反应为CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,故答案为:
,则氧化还原反应的实质是反应过程中有电子转移,常见的氧化还原反应为CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,故答案为: ;Al;HCl;Al;反应过程中有电子转移;CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
;Al;HCl;Al;反应过程中有电子转移;CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
点评 本题考查氧化还原反应,为高频考点,把握电子守恒、原子守恒及反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
20.下列有关说法不正确的是( )
| A. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
2.已知某无色溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
| A. | CO32-、Cl- | B. | Na+、Cu2+ | C. | Mg2+、C1- | D. | C1-、Ba2+ |
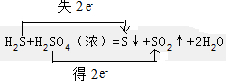 .
.
 H2O2+
H2O2+ 6H+=
6H+= Mn2++
Mn2++ O2↑+
O2↑+ 8H2O;
8H2O;