题目内容
9.下列各组反应中最终肯定是白色沉淀的是( )| A. | AlCl3溶液中加入过量氨水 | B. | Al2(SO4)3溶液中加入过量NaOH溶液 | ||
| C. | FeCl2溶液中加入过量氨水 | D. | CuSO4溶液中加入过量KOH溶液 |
分析 A、反应中生成的氢氧化铝只溶于强酸强碱,不溶于弱酸弱碱,故反应生成氢氧化铝和氯化铵后,氢氧化铝不与过量的氨水反应,最终出现氢氧化铝白色沉淀;
B、反应中Al2(SO4)3溶液与KOH溶液反应生成硫酸钾和氢氧化铝,氢氧化铝又溶解在过量的氢氧化钾溶液中,过程中出现白色沉淀,最终无沉淀;
C、反应中FeCl2加入过量的氨水生成氢氧化亚铁白色沉淀,且沉淀不溶于过量的氨水,但氢氧化亚铁在空气中会迅速被氧气氧化,现象为迅速变为灰绿色最后变为红褐色,最终得到红褐色沉淀;
D、反应中CuSO4溶液中加入过量KOH溶液反应生成了蓝色沉淀.
解答 解:A、AlCl3溶液中加入过量氨水,反应为AlCl3+3NH3•H2O=AI(OH)3↓+3NH4Cl,生成的白色沉淀不溶于过量的氨水,故A正确;
B、Al2(SO4)3溶液中加入过量NaOH溶液,反应为Al3++3OH-=AI(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,故B错误;
C、FeCl2溶液中加入过量氨水,反应为Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+,4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成的是红褐色沉淀,故C错误;
D、CuSO4溶液中加入过量KOH溶液,反应为Cu2++2OH-=Cu(OH)2↓,Cu(OH)2不溶于过量的KOH溶液的蓝色沉淀,故D错误;
故选:A.
点评 本题考查了氢氧化铝的两性、氢氧化亚铁的还原性、氢氧化铜的难溶性等知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.将10mL 0.2mol/L CuSO4溶液与20mL 0.15mol/L Ba(OH)2溶液混合,反应后,溶液中离子浓度最大的是( )
| A. | OH- | B. | SO${\;}_{4}^{2-}$ | C. | Ba2+ | D. | Cu2+ |
13.某烧杯内装有约占其面积$\frac{1}{5}$的食盐水,则该食盐水的体积是(填字母)( )
| A. | 约5mL | B. | 约10mL | C. | 约30mL | D. | 不能确定 |
4.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
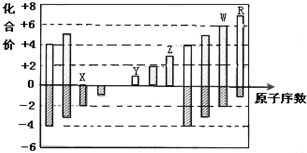

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | 最高价氧化物的水化物的碱性:Y<Z | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
14.下列关于小苏打水溶液的表述,正确的是( )
| A. | c(Na+)=c(HCO3-)+c (CO32-)+2c(H2CO3) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c (OH-) | |
| C. | HCO3-的电离程度大于HCO3-的水解程度 | |
| D. | 存在的电离有:NaHCO3=Na++HCO3-,HCO3-?H++CO32- |
1.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 硅酸胶体:OH-、K+、S2-、Na+ | B. | 空气:C2H4、CO、SO2、NO | ||
| C. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | D. | 高锰酸钾溶液:H+、Na+、SO42-、Fe2+ |
19.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含的电子总数为9 NA | |
| B. | 标准状况下,22.4L氯仿所含的共价键为4NA | |
| C. | 常温常压下,142g C10H22中含共价键的数目为31NA | |
| D. | 标准状况下,22.4L甲烷所含的极性共价键数目为4NA |
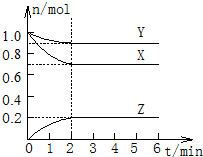 在一定温度下,体积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,完成下列填空:
在一定温度下,体积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,完成下列填空: