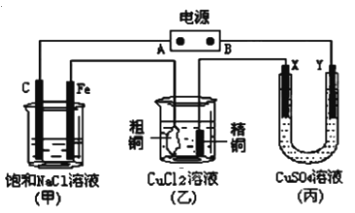
��Ŀ����
����Ŀ����һ�������£���3 mol A��1 mol B������������2L�����ܱ������У��������·�Ӧ��3A(g) + B(g)![]() xC(g)+2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L-l�������ж���ȷ���ǣ� ��
xC(g)+2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L-l�������ж���ȷ���ǣ� ��
A. A��ת����Ϊ40%
B. 2 min��B�ķ�Ӧ����Ϊ0.2 mol��L-l��min-1
C. x=2
D. �����������ܶȲ��䣬������÷�Ӧ�Ѵﵽƽ��״̬
���𰸡�A
���������������������0.8molD������0.8��3/2mol=1.2mol,��A��ת������1.2/3��100%=40%������ȷ��B������0.8molD��ͬʱ������B�����ʵ���Ϊ0.8/2mol=0.4mol�����B�ķ�Ӧ������0.4/(2��2)mol/(L��min)=0.1mol/(L��min)���ʴ���C������C�����ʵ���Ϊ0.2��2mol=0.4mol����x=1���ʴ���D�������ܶȵĶ��壬�����������䣬���巴Ӧǰ������ϵ��֮����ȣ���n���䣬����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬�ʴ���

��ϰ��ϵ�д�
 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д�
�����Ŀ