题目内容
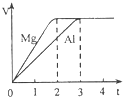 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系错误的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系错误的是( )| A、物质的量之比为3:2 | B、质量之比为3:2 | C、摩尔质量之比为8:9 | D、反应速率之比为3:2 |
分析:根据图象可知,镁和铝分别与等浓度、等体积的过量稀硫酸反应,两种金属得到的氢气一样多,说明转移电子数相等,然后结合金属镁、铝和足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑进行分析解答.
解答:解:B.由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:
=3:2,故A正确;
B.根据B知,二者的物质的量之比为3:2,根据m=nM知,二者的质量的比为(3×24):(2×27)=4:3,故B错误;
C.Mg的摩尔质量是24g/mol,铝的摩尔质量是27g/mol,其摩尔质量之比=24g/mol:27g/mol=8:9,故C正确;
D.根据v=
知,当气体体积相同时,反应速率与其时间成反比,所以二者反应速率之比3:2,故D正确;
故选:B.
| 2 |
| 3 |
B.根据B知,二者的物质的量之比为3:2,根据m=nM知,二者的质量的比为(3×24):(2×27)=4:3,故B错误;
C.Mg的摩尔质量是24g/mol,铝的摩尔质量是27g/mol,其摩尔质量之比=24g/mol:27g/mol=8:9,故C正确;
D.根据v=
| △V |
| △c |
故选:B.
点评:本题以图象形式考查混合物计算、金属与酸的反应,难度不大,注意结合方程式进行分析解答,知道相同条件下,物质反应速率取决于物质本身的性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
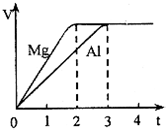 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )| A、物质的量之比为3:2 | B、质量之比为3:4 | C、摩尔质量之比为8:9 | D、体积之比为2:3 |
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
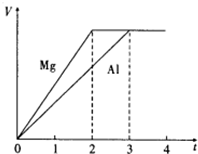
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )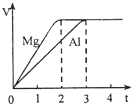 (2009?上海)镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
(2009?上海)镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )