题目内容
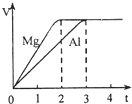 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.关于反应中镁和铝的说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.关于反应中镁和铝的说法正确的是( )分析:根据图象可知,两种金属得到的氢气一样多,然后根据金属镁、铝和足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,即可找出各个量之间的关系.
解答:解:A、由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:
=3:2,则它们的质量的比为(3×24):(2×27)=4:3,故A错误;
B、由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:
=3:2,故B错误;
C、镁和铝的摩尔质量之比和该化学反应毫无关系,即它们的摩尔质量之比为24:27=8:9,故C错误;
D、两种金属得到的氢气一样多,由H2SO4~H2可知,消耗硫酸的物质的量之比为1:1,故D正确;
故选D.
| 2 |
| 3 |
B、由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:
| 2 |
| 3 |
C、镁和铝的摩尔质量之比和该化学反应毫无关系,即它们的摩尔质量之比为24:27=8:9,故C错误;
D、两种金属得到的氢气一样多,由H2SO4~H2可知,消耗硫酸的物质的量之比为1:1,故D正确;
故选D.
点评:本题以图象形式考查混合物计算、金属与酸的反应,难度不大,注意根据化学方程式进行有关的计算.

练习册系列答案
相关题目
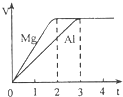 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系错误的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系错误的是( )| A、物质的量之比为3:2 | B、质量之比为3:2 | C、摩尔质量之比为8:9 | D、反应速率之比为3:2 |
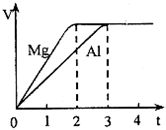 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )| A、物质的量之比为3:2 | B、质量之比为3:4 | C、摩尔质量之比为8:9 | D、体积之比为2:3 |
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )