题目内容
下列说法正确的是
| A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
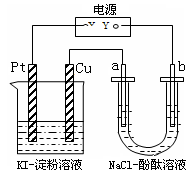
| B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
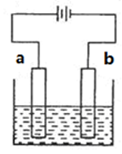
| C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
B
试题分析:A、惰性电极电解稀硫酸溶液,相当于是电解水,溶液的浓度会逐渐变大,酸性逐渐增强,所以pH逐渐变小,A不正确;B、氯碱工业中,电路中每转移1mol电子,理论上阴极和阳极分别收集到0.5mol氢气和0.5mol氯气,共收集到1mol气体,B正确;C、惰性电极电解饱和食盐水,得到氢氧化钠、氢气和氯气,所以向电解氯化钠溶液所得的稀溶液中,通入氯化氢气体,能恢复到原溶液浓度,C不正确;D、D、粗铜精炼时,粗铜应作电解池的阳极,但由于粗铜中含有锌、铁等活泼性强于铜的杂质,所以锌、铁等首先失去电子,而阴极始终是铜离子放电,所以电解质溶液在电解过程中浓度减小,D不正确,答案选B。

练习册系列答案
相关题目