题目内容
已知A、B、C、D为短周期主族元素,其相对位置关系如图。C与B可形成离子化合物C3B2。下列分析正确的是 ( )。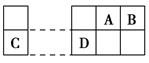
A.电负性:C>A
B.离子氧化性:C>D
C.氢化物稳定性:A>B
D.原子半径:r(C)>r(B)
D
解析

练习册系列答案
相关题目
用下表提供的仪器和药品,能达到实验目的的是
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
| B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、 碳酸钠溶液 | 证明非金属性:Cl>C>Si |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、 待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 酒精灯、玻璃棒、 蒸发皿、铁架台(带铁圈) | NaCl溶液 | 蒸发溶液得到晶体 |
W、X、Y、Z为原子序数递增的四种短周期元素。W是原子半径最小的元素,X的一种核素在考古时常用来鉴定一些文物的年代,Y是植物生长所需化学肥料中主要的营养元素之一,Z原子的最外层电子数是X原子最外层电子数的1.5倍。下列说法正确的是:
| A.氢化物的沸点:Z一定高于Y |
| B.最高价氧化物对应水化物的酸性:X强于Y |
| C.仅由W、Y、Z三种元素组成的化合物不可能属于盐类 |
| D.W、X、Y、Z都能分别与氯元素形成共价化合物 |
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
则下列有关比较中正确的是( )
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
| A.X与W形成的化合物W2X2中含有离子键和共价键 |
| B.原子半径大小的顺序为W>X>Y>Z |
| C.Y、Z两元素形成的简单阴离子的还原性Z>Y |
| D.Y、Z两元素最高价氧化物对应水化物的酸性Z>Y |
元素周期表和元素周期律对化学学习具有指导意义,下列有关叙述正确的是( )
| A.铅位于周期表中金属与非金属元素交界处,可做半导体材料 |
| B.若存在简单阴离子R2-,则R一定属于第ⅥA族元素 |
| C.S和Se属于第ⅥA族元素,H2S还原性比H2Se的强 |
| D.元素原子最外层电子数较少的金属一定比最外层电子数较多的金属活动性强 |
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是 ( )。
| A.电子排布式为1s22s22p63s23p63d34s2 |
| B.该元素为V |
| C.该元素为ⅡA族元素 |
| D.该元素位于d区 |
不能说明元素X的电负性比元素Y的大的是 ( )
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
下列四种元素中,其单质氧化性最强的是( )。
| A.原子含有未成对电子最多的第2周期元素 |
| B.位于周期表第3周期ⅢA族的元素 |
| C.原子最外电子层排布式为2s22p6的元素 |
| D.原子最外电子层排布式为3s23p5的元素 |