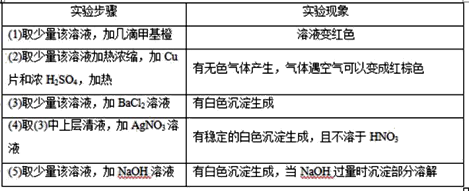
题目内容
【题目】工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
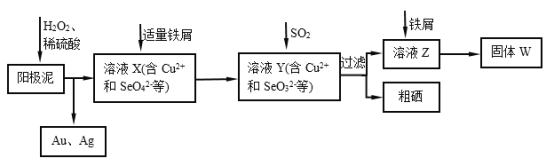
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
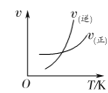
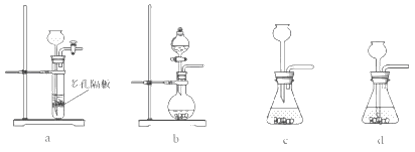
(4)实验室中制取SO2的原理为:Na2SO4+H2SO4=Na2SO4+H2O+SO2↑,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H=2H2O②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O③I2+2Na2S2O3=Na2S4O6+2NaI通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量,滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol/L的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 __________。
【答案】将SeO42-还原为SeO32- 过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离 取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42- 粗盐提纯、一定物质的量浓度溶液的配制、物质的溶解、溶液的蒸发、浓硫酸的稀释等 较浓的硫酸 SO2易溶于水,用较浓的硫酸有利于SO2的逸出 b 锥形瓶、碱式滴定管 90.85%
【解析】
(1)根据流程图分析加入铁屑后溶液中的离子变化;根据铁粉具有较强的还原性,结合溶液中的离子分析;(2)根据流程图可知前面加入二氧化硫,则溶液中有硫酸根离子,根据检验硫酸根的方法分析;(3)根据玻璃棒在实验中的作用分析;(4)二氧化硫在水中的溶解度较大,在浓硫酸中溶解度较小;根据反应的特点选择装置;(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放;根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=cV计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=nM计算Se的质量,进而计算样品中Se的质量分数。
(1)根据流程图可知加入铁屑后溶液中的SeO42被还原为SeO32,所以向溶液X中加入铁屑的作用是:将SeO42被还原为SeO32;铁粉具有较强的还原性,能还原Cu2+、SeO32,所以加过量铁粉会将Cu2+、SeO32均还原为单质,不利于硒的分离;故答案为:将SeO42-还原为SeO32-;过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离;
(2)根据流程图可知前面加入二氧化硫,则溶液中有硫酸根离子,检验硫酸根的方法为:取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42;故答案为:取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42;
(3)实验操作中常常用到玻璃棒,溶解时用玻璃杯搅拌,过滤时用玻璃棒引流,溶液蒸发用玻璃杯搅拌等;故答案为:物质的溶解、溶液的蒸发等;
(4)二氧化硫在水中的溶解度较大,在浓硫酸中溶解度较小,用较浓的硫酸有利于SO2的逸出,所以选用较浓的硫酸与亚硫酸钠反应;根据实验室中制取SO2的原理为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,可知该反应为固体粉末与液体的反应,不需要加热,使用分液漏斗加硫酸容易控制加入硫酸的量,所以最好选用如图2中的b;故答案为:较浓的硫酸;SO2易溶于水;用较浓的硫酸有利于SO2的逸出;b;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放,则滴定操作中用到的玻璃仪器有锥形瓶、碱式滴定管;根据反应的方程式可知SeO22I24Na2S2O3,消耗的n(Na2S2O3)=0.2000mol/L×0.0276L=0.00552mol,根据关系式计算样品中n(SeO2)=0.00552mol×14=0.00138mol,故Se的质量为0.00138mol×79g/mol=0.10902g,所以样品中Se的质量分数为![]() 故答案为:锥形瓶、碱式滴定管;90.85%。
故答案为:锥形瓶、碱式滴定管;90.85%。

 名校课堂系列答案
名校课堂系列答案【题目】环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
![]()
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为_______________。
②蒸馏不能分离环己酮和水的原因是_______________。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分; b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4固体,除去有机物中的少量水。
①上述操作的正确顺序是________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需__________。
③在上述操作c中,加入NaCl 固体的作用是____________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有___种不同化学环境的氢原子。