题目内容
下列说法不正确的是
| A.用排水法收集NO可以除去其中少量的NO2 |
| B.工业氨氧化法制HNO3,每一步都涉及氧化还原反应 |
| C.用NaOH溶液除去Cl2中含有的少量HCl |
| D.向含硫燃煤中添加适量CaO可以减少SO2的排放 |
C
试题分析:NO不溶于水,二氧化氮易溶于水,且3NO2+H2O=2HNO3+NO,故A选项正确;工业氨氧化法制硝酸主要包括三步,即4NH3+4O2
 4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,氮元素先由—3价升为+2价,再由+2价升为+4价,最后由+4价升为+5价,每一步都涉及元素的化合价的升降变化,都是氧化还原反应,故B选项正确;不仅HCl与NaOH溶液容易发生中和反应,而且Cl2与NaOH溶液容易发生氧化还原反应,因此不能选择NaOH溶液除去氯气中混有的少量氯化氢,应选择饱和食盐水除杂,故C选项错误;二氧化硫是酸性氧化物,具有酸性氧化物的通性,氧化钙是碱性氧化物,具有碱性氧化物的通性,二者容易化合,将有毒的二氧化硫气体变为亚硫酸钙固体,故D选项正确。2的方法、氨氧化法制硝酸的每一步反应原理、氧化还原反应与非氧化还原反应、除去氯气中混入的少量氯化清的试剂、氧化钙的性质、煤燃烧排放的二氧化硫如何减排等。
4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,氮元素先由—3价升为+2价,再由+2价升为+4价,最后由+4价升为+5价,每一步都涉及元素的化合价的升降变化,都是氧化还原反应,故B选项正确;不仅HCl与NaOH溶液容易发生中和反应,而且Cl2与NaOH溶液容易发生氧化还原反应,因此不能选择NaOH溶液除去氯气中混有的少量氯化氢,应选择饱和食盐水除杂,故C选项错误;二氧化硫是酸性氧化物,具有酸性氧化物的通性,氧化钙是碱性氧化物,具有碱性氧化物的通性,二者容易化合,将有毒的二氧化硫气体变为亚硫酸钙固体,故D选项正确。2的方法、氨氧化法制硝酸的每一步反应原理、氧化还原反应与非氧化还原反应、除去氯气中混入的少量氯化清的试剂、氧化钙的性质、煤燃烧排放的二氧化硫如何减排等。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

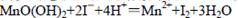
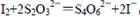 ,
,