题目内容
近期,我国个别企业违法排污导致地下
水严重污染又成为媒体焦点。对水的质量监控
有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。
I.对溶解氧(DO)的测定步骤是:
①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+:
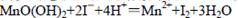
③最后用0.0100 mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2: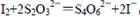 ,
,
消耗Na2S2O3标准溶液11.00mL。
(1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。
(2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:________。
(3)水样中溶解氧(DO)的浓度为 mg·L-1。
II.该实验需用Na2S2O3固体配制100mL 0.0100 mol·L-1Na2S2O3标准溶液。
(4)请按配制的过程填写选用仪器的顺序:____ (填编号)。
①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯
(5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。
E.用天平称量药品时,左盘低,右盘高
水严重污染又成为媒体焦点。对水的质量监控
有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。
I.对溶解氧(DO)的测定步骤是:
①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:

②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+:
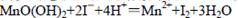
③最后用0.0100 mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2:
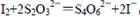 ,
,消耗Na2S2O3标准溶液11.00mL。
(1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。
(2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:________。
(3)水样中溶解氧(DO)的浓度为 mg·L-1。
II.该实验需用Na2S2O3固体配制100mL 0.0100 mol·L-1Na2S2O3标准溶液。
(4)请按配制的过程填写选用仪器的顺序:____ (填编号)。
①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯
(5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。
| A.没有用蒸馏水洗涤烧杯 |
| B.定容时俯视容量瓶刻度线 |
| C.配制前容量瓶洗净后没干燥 |
| D.摇匀后见液面下降,再加水至刻度线 |
(14分)
(1)蓝色变为无色且半分钟之内不恢复蓝色 (2分);
(2) 碱式 (2分);Na2S2O3为强碱弱酸盐,S2O32-水解使溶液呈碱性(S2O32-+ H2O HS2O3-+ OH-),会腐蚀酸式滴定管活塞。(3分)
HS2O3-+ OH-),会腐蚀酸式滴定管活塞。(3分)
(3)8.8 (2分)
(4)④⑤①③②(2分)
(5)BE(2分)
(1)蓝色变为无色且半分钟之内不恢复蓝色 (2分);
(2) 碱式 (2分);Na2S2O3为强碱弱酸盐,S2O32-水解使溶液呈碱性(S2O32-+ H2O
 HS2O3-+ OH-),会腐蚀酸式滴定管活塞。(3分)
HS2O3-+ OH-),会腐蚀酸式滴定管活塞。(3分)(3)8.8 (2分)
(4)④⑤①③②(2分)
(5)BE(2分)
试题分析:
(1)I2遇淀粉试液显蓝色,用0.0100 mol·L-1Na2S2O3标准溶液滴定
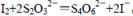 ,直至I2反应完。
,直至I2反应完。(2)Na2S2O3溶液呈碱性。
(3)分析题中反应:①
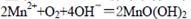 ②
②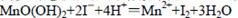 ③
③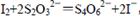 ,可得关系式:4 S2O32-~O2,100.00mL新鲜水样中n(O2)="1/4" n(S2O32-)=
,可得关系式:4 S2O32-~O2,100.00mL新鲜水样中n(O2)="1/4" n(S2O32-)=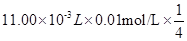 ,则1L中m(O2)=
,则1L中m(O2)=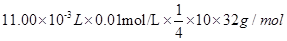 ="0.088g=8.8" mg,
="0.088g=8.8" mg,(4)配置一定物质的量浓度的溶液步骤。
(5)B.俯视容量瓶刻度线导致V偏小,c偏高;E.用天平称量药品时,左盘低,右盘高,物品的实际质量偏大,c偏高。

练习册系列答案
相关题目
 CH3CH2OH
CH3CH2OH 2CH3CH2OH + 2CO2 ↑
2CH3CH2OH + 2CO2 ↑ CH3CH2OH + HBr
CH3CH2OH + HBr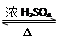 CH3CH2OH + CH3CH2COOH
CH3CH2OH + CH3CH2COOH