题目内容
18.某些化学键的键能如表(kJ•mol-1):| 键 | H-H | Br-Br | I-I | H-CL | H-CL | H-I | H-Br |
| 键能 | 436 | 193 | 243 | 431 | 431 | 298 | 366 |
(2)1mol H2在足量C12中燃烧,放出热量183kJ.
分析 (1)物质中的化学键键能越大,断裂时吸收的热量越多,则化学键越稳定;
(2)反应焓变=反应物总键能-生成物总键能.
解答 解:(1)根据表格中的数据可知,物质中H-H键能最大,断裂时吸收的能量越多,越难以断裂,所以H-H最稳定,故答案为:H2;
(2)反应焓变=反应物总键能-生成物总键能,由H2+Cl2=2HCl可知△H=243kJ/mol+436kJ/mol-431kJ/mol×2=-183kJ/mol,放出183kJ,故答案为:183.
点评 本题考查了反应能量变化分析判断,主要是根据键能计算反应焓变的应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
9.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 20 mL 10 mol•L-1的浓硝酸与足量铜加热反应转移电子数为0.2NA | |
| B. | 标准状况下,11.2L氦气中含有NA原子 | |
| C. | 在精炼铜或电镀铜的过程中,当阳极消耗铜32g时,转移电子数均为NA | |
| D. | 标准状况下,2.24L Cl2通入足量NaOH溶液中发生反应转移的电子数为0.1NA |
6.下列溶液中各组离子因水解而不能够大量共存的是( )
| A. | AlO2-、Na+、HCO3-、K+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Al3+、Cl-、CO32- | D. | Cu2+、NH4+、I-、Cl- |
4.有Fe、CuO和Fe2O3组成的混合物共mg,放入500mL lmol•L-1 HNO3溶液中,混合物完全溶解,生成2.24L(标准状况下)NO,再向反应后的溶液中加入200mLNaOH溶液,要使铁和铜元素完全沉淀下来,所加入的NaOH溶液的浓度最小是( )
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |

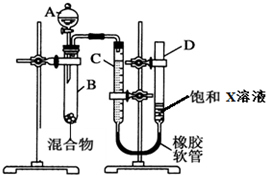 为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.
为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.