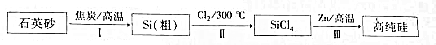题目内容
10.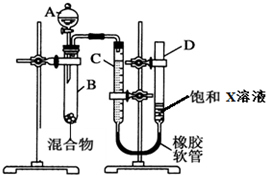 为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.
为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.(1)A装置的名称为分液漏斗
(2)C、D装置中的饱和X溶液应该选下列中的d(填序号)
a.NaOH溶液 b.蒸馏水
c.碳酸钠溶液 d.碳酸氢钠溶液
A中选用的试剂为稀H2SO4而不能选稀HCl的原因是盐酸会挥发出HCl 与C、D中NaHCO3反应,生成CO2,使测得的CO2体积偏大
(3)实验结束读数之前,要进行的操作是上下移动D管,使液面相平再读数
(4)实验结束后,C中测得的生成的气体换算到标况下体积为a mL,则混合物中Na2CO3的质量分数为$\frac{106×(m-\frac{84a×1{0}^{-3}}{22.4})}{22m}$×100%(可以不化简).
分析 测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,由装置可知,A为分液漏斗,A中为稀硫酸,与NaHCO3、Na2CO3均反应生成CO2,C、D为玻璃管,C带有刻度,则C和D测定生成CO2的体积,X应为碳酸氢钠溶液,碳酸氢钠溶液可抑制二氧化碳的溶解,然后利用混合物质量及二氧化碳的体积可计算碳酸钠的质量,以此来解答.
解答 解:测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,由装置可知,A为分液漏斗,A中为稀硫酸,与NaHCO3、Na2CO3均反应生成CO2,C、D为玻璃管,C带有刻度,则C和D测定生成CO2的体积,X应为碳酸氢钠溶液,碳酸氢钠溶液可抑制二氧化碳的溶解,然后利用混合物质量及二氧化碳的体积可计算碳酸钠的质量,
(1)由图可知A为分液漏斗,故答案为:分液漏斗;
(2)二氧化碳与NaOH、碳酸钠均反应,可溶于水,碳酸氢钠溶液可抑制二氧化碳的溶解,则C、D装置中的饱和X溶液应为d;A中选用的试剂为稀H2SO4而不能选稀HCl的原因是盐酸会挥发出HCl 与C、D中NaHCO3反应,生成CO2,使测得的CO2体积偏大,
故答案为:d;盐酸会挥发出HCl 与C、D中NaHCO3反应,生成CO2,使测得的CO2体积偏大;
(3)实验结束读数之前,要进行的操作是上下移动D管,使液面相平再读数,故答案为:上下移动D管,使液面相平再读数;
(4)C中测得的生成的气体换算到标况下体积为a mL,n(CO2)=$\frac{a×1{0}^{-3}L}{22.4L/mol}$,混合物样品m g,设NaHCO3、Na2CO3的物质的量分别为x、y,则
$\left\{\begin{array}{l}{84x+106y=m}\\{x+y=\frac{a×1{0}^{-3}}{22.4}}\end{array}\right.$,解得y=$\frac{(m-\frac{84a×1{0}^{-3}}{22.4})}{22}$mol,
则Na2CO3%=$\frac{106×(m-\frac{84a×1{0}^{-3}}{22.4})}{22m}$×100%,故答案为:$\frac{106×(m-\frac{84a×1{0}^{-3}}{22.4})}{22m}$×100%.
点评 本题考查物质含量的测定,为高频考点,把握碳酸盐的性质及实验中发生的反应、含量测定方法为解答的关键,侧重分析、实验及计算能力的考查,题目难度不大.

| A. | 测定中和热时,用环形铜质搅拌棒搅拌溶液,使测得的温度更准确 | |
| B. | 利用烧杯、玻璃棒、量筒、容量瓶就可以配制2mol•L-1的硫酸溶液 | |
| C. | 用稀NaOH溶液除去溴苯中混有的Br2 | |
| D. | 用酒精萃取碘水中的碘 |
| 键 | H-H | Br-Br | I-I | H-CL | H-CL | H-I | H-Br |
| 键能 | 436 | 193 | 243 | 431 | 431 | 298 | 366 |
(2)1mol H2在足量C12中燃烧,放出热量183kJ.

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)II.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,与实验Ⅲ相比,实验Ⅳ的突出优点是(填选项序号)D.
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便 D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是(填化学式)NaHCO3.
(4)将碳酸钠和碳酸氢钠固体分别配制成0.5mol•L-1的溶液,探究与0.5mol•L-1CaCl2溶液反应的情况
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应. | 有白色沉淀 |
| 实验2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应. | 既有白色沉淀出现,同时又有少量气泡冒出. |
实验1:Ca2++CO32-=CaCO3↓;实验2:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O.
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则溶液中有CO${\;}_{3}^{2-}$ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO${\;}_{4}^{2-}$ | |
| C. | 加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |