题目内容
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:
(1)吸硫装置如图所示:
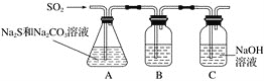
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________,表明SO2吸收效率低的实验现象是B中_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________、________。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知:![]() +I2=
+I2=![]() +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 ____(填“无影响”、“偏低”或“偏高”),原因是_________。
【答案】品红、溴水或KMnO4溶液 溶液颜色很快褪色 控制SO2的流速 适当升高温度 ![]() 偏低 4I-+4H++O2=2I2+2H2O,第三步滴速太慢,过量KI会被氧化产生碘单质,导致消耗的硫代硫酸钠溶液的体积增加,c(Na2S2O3)=
偏低 4I-+4H++O2=2I2+2H2O,第三步滴速太慢,过量KI会被氧化产生碘单质,导致消耗的硫代硫酸钠溶液的体积增加,c(Na2S2O3)=![]() ,V增大,c(Na2S2O3)偏低。
,V增大,c(Na2S2O3)偏低。
【解析】
(1)①装置B的作用是检验装置A中SO2的吸收效率,若A中SO2吸收的效率高,则进入B中的SO2速率慢,B中溶液变化就缓慢,反之则迅速,故B中试剂能与SO2反应且存在明显的现象,故B中的试剂是品红、溴水或KMnO4溶液等,若A中SO2吸收的效率低,B中溶液颜色很快褪色;②根据影响反应的速率的因素可知,使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积、控制SO2的流速、适当升高温度;
(2)检验Cl—用AgNO3溶液,检验NaOH的存在需要利用pH测定,即向溶液加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH,若有NaOH溶液存在时,pH应大于10.2;
(3)由已知可以写出IO3-+5I-+6H+== 3I2+3H2O、2S2O32-+I2==S4O62-+2I-可得IO3-~3I2~6S2O32-,a g KIO3的物质的量为ag ÷214g/mol,c(Na2S2O3)=6×ag ÷214g/mol÷(VmL×10—3mL/L)=6000a/214V=3000a/107V。
(1)①二氧化硫具有还原性、漂白性,所以可以用品红、溴水或KMnO4溶液,来检验二氧化硫是否被完全吸收,若SO2吸收效率低,则二氧化硫有剩余,B中的溶液会褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,可以减缓二氧化硫的流速,使二氧化硫与溶液充分接触反应,适当升高温度,也能使二氧化硫充分反应;
(2)KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2Na2S2O3=Na2S4O6+2NaI;
n(KIO3)=mol,设参加反应的Na2S2O3为xmol;
KIO3~~~~3I2~~~~6Na2S2O3
1 6
![]() mol xmol
mol xmol
所以 x= ![]() ,则c(Na2S2O3)=
,则c(Na2S2O3)=![]() =
=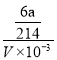 =
=![]() molL-1;
molL-1;
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能偏低,原因是4I-+4H++O2=2I2+2H2O,第三步滴速太慢,过量KI会被氧化产生碘单质,导致消耗的硫代硫酸钠溶液的体积增加,c(Na2S2O3)=![]() ,V增大,c(Na2S2O3)偏低。
,V增大,c(Na2S2O3)偏低。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案