题目内容
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
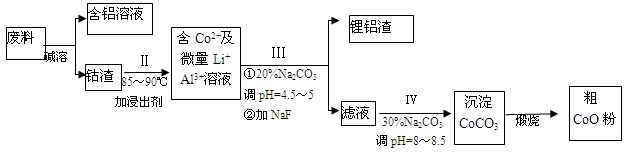
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
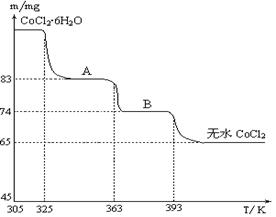
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。

(1)2Al+2OH-+2H2O = 2AlO- 2+3H2↑(2)还原Co3+ (其它合理答案也给分)Co2O3·CoO可氧化盐酸产生Cl2,污染环境。(其它合理答案也给分)(3)CO32-+Co2+= CoCO3↓(4)CoCl2?H2O
试题分析:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑;(2)根据题意知,Co2O3·CoO和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,加入Na2S2O3的作用是还原Co3+ ;盐酸具有还原性,能被Co2O3?CoO氧化生成有毒的氯气而污染环境;(3)碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;离子方程式为CO32-+Co2+= CoCO3↓;(4)根据题给图像知,
CoCl2?6H2O~CoCl2
238 130
m 65mg
解得:m=119mg
设 A物质的化学式为CoCl2?nH2O,则有:
CoCl2?6H2O~CoCl2?nH2O △m
238 18(6-n)
119mg 119mg-83mg
解得:n=2,所以A物质的化学式为:CoCl2?2H2O。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。