题目内容
(10分)将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL、质量分数为63.0%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.00mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1)浓硝酸中HNO3的物质的量浓度。
(2)该合金中铜与镁的物质的量之比为 。
(3) NO2和N2O4的混合气体中,NO2的体积分数是 。
(1)浓硝酸中HNO3的物质的量浓度。
(2)该合金中铜与镁的物质的量之比为 。
(3) NO2和N2O4的混合气体中,NO2的体积分数是 。
(1)C(HNO3)=14mol/L;(2)2:1;(3)80%
试题分析:(1)根据金属的物质的量浓度与质量分数的换算关系可知:C="(ρ×1000×ω)÷M" ="(1.40×1000×63.0%)" ÷63=14mol/L;在化学反应中金属失去的电子的物质的量等于硝酸得到的电子的物质的量等于形成沉淀时的氢氧根离子的物质的量。铜镁都是+2价的金属,金属增加的质量就是OH-的质量。m(OH-)= 2.54g-1.52g=1.02g。n(OH-)=1.02g÷17g/mol=0.06mol.则n(Mg)+n(Cu)=0.03mol.因为24 n(Mg)+64n(Cu)= 1.52。n(Mg)="0.01mol;" n(Cu)=0.02mol.所以该合金中铜与镁的物质的量之比为0.02:0.01=2:1.(3)1120mL混合气体的物质的量是0.05mol。假设NO2和N2O4的混合气体中,NO2的物质的量是x,则N2O4的物质的量是(0.05-x)mol.根据电子守恒可得x+2(0.05-x)= 0.06mol.解得x=0.04mol.对于气体来说,气体的体积比等于它们的物质的量的比。所以NO2的体积分数是(0.04mol÷0.05mol)×100%=80%。

练习册系列答案
相关题目
 Cu2S+FeS+SO2 则下列说法正确的是
Cu2S+FeS+SO2 则下列说法正确的是 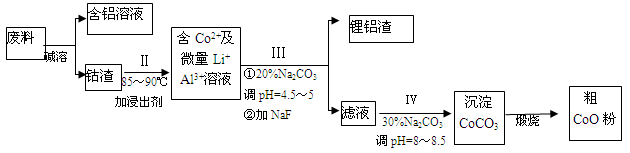
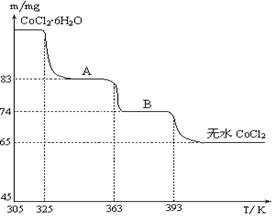
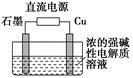
 Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。