题目内容
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
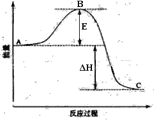
(1)图中E表示__________。E的大小对该反应的反应热_______(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H______(填“变大”、“变小”或“不变”)。
(3)图中△H=___________kJ·mol-1;
(4)当反应达到平衡时,升高温度,反应速率_______ (增大”“减小”或“不变”),SO2的转化率_________ (增大”“减小”或“不变”),原因是______________________
【答案】 正反应活化能 无 不变 -198 增大 减小 该反应为放热反应,升高温度,平衡逆向移动,故SO2转化率减小
【解析】(1)由图可得,E表示正反应的活化能,E与ΔH的数值之和表示逆反应的活化能,ΔH表示反应热,所以E的大小对该反应的反应热无影响。
(2)加入催化剂,改变了反应历程,使反应的活化能降低,活化能的大小对反应热无影响,故△H不变。
(3)1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJmol-1,所以2molSO2(g)氧化为2mol SO3(g)的△H=-198kJmol-1,故图中△H=-198kJmol-1。
(4)升高温度,化学反应速率增大,该反应为放热反应,升高温度,平衡逆向移动,故SO2转化率减小。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目