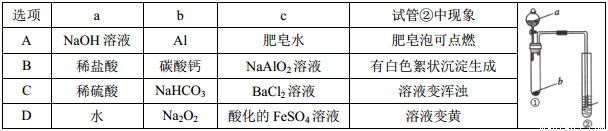
题目内容
【物质结构与性质】 (15 分)
钒、砷均属于第四周期元素,最高正价均为+5。
I .高纯度砷可用于生产具有“半导体贵族”之称的新型半导体材料GaAs,砷与氯气反应可得到 AsCl3、AsCl5两种氯化物。
(1)AsCl3分子的空间构型是 ,中心原子杂化类型是 。两种氯化物分子中属于非极性分子的是 。
(2)Ga与As相比,第一电离能较小的元素是 ,GaAs中砷的化合价为 。
II.钒是一种重要的战略金属,其最主要的用途是生产特种钢,其化合价有+5、+4、+3、+2等,工业上从炼钢获得的富钒炉渣中(内含 V2O5)提取钒的过程如下。

(3)基态钒原子的价电子排布式为 ,写出反应①的化学方程式: 。
(4)已知单质钒的晶胞为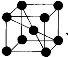 ,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目


 、
、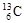 、
、 说法错误的是( )
说法错误的是( ) ·L-1
·L-1
 -1 B.-259.7kJ·mol-1
-1 B.-259.7kJ·mol-1 kJ·mol-1 D.-519.4kJ·mol-1
kJ·mol-1 D.-519.4kJ·mol-1 于干燥H2S和CO2
于干燥H2S和CO2