题目内容
用0.1000mol/LNaOH溶液滴定未知浓度的盐酸,进行以下滴定操作:
A.用蒸馏水洗净碱式滴定管,然后用标准NaOH溶液润洗,再将标准NaOH溶液装入碱式滴定管中,调整液面至零刻度线。
B.用酸式滴定管量取25.00mL盐酸于锥形瓶中,并滴加几滴酚酞指示剂。
C.在锥形瓶下垫一张白纸,滴定至终点,记下读数为20.00mL。就此实验完成下列填空:
(1)滴定时眼睛应观察______________ 。
(2)滴到终点,溶液的颜色由_______色变为_______色,且半分钟内不褪色。
(3)根据上述数据求得盐酸的物质的量浓度为 __________mol/L。
A.用蒸馏水洗净碱式滴定管,然后用标准NaOH溶液润洗,再将标准NaOH溶液装入碱式滴定管中,调整液面至零刻度线。
B.用酸式滴定管量取25.00mL盐酸于锥形瓶中,并滴加几滴酚酞指示剂。
C.在锥形瓶下垫一张白纸,滴定至终点,记下读数为20.00mL。就此实验完成下列填空:
(1)滴定时眼睛应观察______________ 。
(2)滴到终点,溶液的颜色由_______色变为_______色,且半分钟内不褪色。
(3)根据上述数据求得盐酸的物质的量浓度为 __________mol/L。
(1)锥形瓶中溶液的颜色变化
(2)无 ; 粉红(浅红)
(3)0.08000
(2)无 ; 粉红(浅红)
(3)0.08000

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
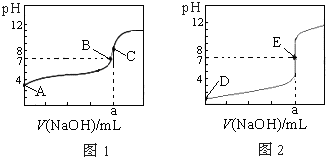 如图为常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1盐酸和20.00mL 0.1000mol?L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图为常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1盐酸和20.00mL 0.1000mol?L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )| A、图1是滴定盐酸的曲线 | B、B、E状态时,两溶液中离子浓度均为c(Na+)=c(A-) | C、C、E状态时,反应消耗的酸n(CH3COOH)=n(HCl) | D、当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) |
 (2011?奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( )
(2011?奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( ) (2010?江苏)常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
(2010?江苏)常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )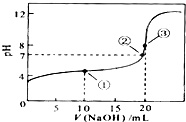 常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是( )