题目内容
在水溶液中能大量共存的一组离子是
| A.S2—、Al3+、ClO-、Cl- | B.K+、Mg2+、OH-、NO3- |
| C.H+、Mg2+、SiO32-、SO42- | D.NH4+、Na+、Cl-、SO42- |
D
解析试题分析:A、S2—与ClO-因发生氧化还原反应而不能大量共存,错误;B、Mg2+与OH-反应生成氢氧化镁沉淀而不能大量共存,错误;C、H+与SiO32-反应生成硅酸沉淀不能大量共存,错误;D、4种离子彼此不反应,可以大量共存,正确,答案选D。
考点:考查离子反应的大量共存

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
下列说法正确的是(N A表示阿伏加德常数)
| A.1molCu与足量硫反应生成Cu2S,转移的电子数为2 N A |
B.R2+的质量数为A,中子数为N,则ngR该价态的氧化物中含质子数为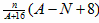 N A N A |
| C.氯化铁生成Fe(OH)3胶体的离子方程式:Fe3++3H2O =Fe(OH)3↓+3H+ |
| D.在加入铝片能生成氢气的溶液中一定共存的离子组:Na+、Ba2+、Cl-、NO3- |
下列各组物质,前者加入后者时,无论前者是否过量,都能用同一离子方程式表示的是
| A.稀盐酸,Na2CO3溶液 |
| B.氯化铝溶液,氨水 |
| C.碳酸氢钠溶液,澄清石灰水 |
| D.溴化亚铁溶液,氯水 |
下列图示与对应的叙述相符的是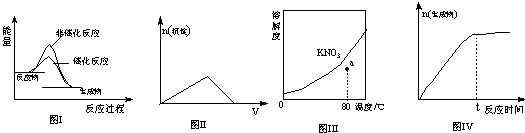
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示表示向KAl(SO4)2溶液中滴加Ba(OH)2溶液产生沉淀的物质的量(n)随氢Ba(OH)2溶液体积(V)的变化 |
| C.图Ⅲ表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图Ⅳ表示某可逆反应生成物的物质的量随反应时间变化的曲线,t时刻反应正速率最大 |
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)。
| 阳离子 | Mg2+、Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五种离子。则A的化学式不可能是( )
A.AgNO3 B.Na2SO4 C.MgCl2 D.MgSO4
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaI溶液:K+、H+、 、 、 |
B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、 、Cl- 、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl- |
D.0.1 mol·L-1的氨水:Cu2+、Na+、 、 、 |
下列离子方程式书写正确的是
| A.氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
B.碳酸钠溶液中逐滴加入等物质的量的盐酸: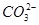 +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
C.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O=HClO+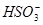 |
D.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++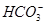 +OH-=CaCO3↓+H2O +OH-=CaCO3↓+H2O |
有一无色溶液,可能含有K+、Al3+、Mg2+、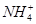 、Cl-、
、Cl-、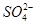 、
、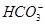 、
、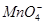 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+、Mg2+、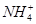 、Cl- 、Cl- |
B.肯定有Al3+、Mg2+、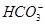 |
C.肯定有K+、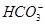 、 、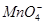 |
D.肯定有Al3+、Mg2+、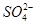 |
下列解释事实的离子方程式不正确的是( )。
A.氨水使酚酞溶液变红:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.醋酸使碳酸钙溶解:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C.草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |