题目内容
某硝酸厂附近的空气主要污染物为氮的氧化物.为了保护环境和综合利用,可采用氨-碱两级吸收法.此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
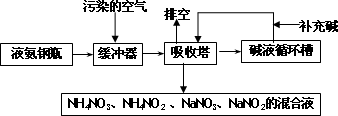
(1)排空物质的主要成分为________.
(2)进入吸收塔以前加一个缓冲器的目的是________.
(3)从吸收塔排出的混合液用途之一为________.
空气的主要污染物为硫的氧化物和氮的氧化物.研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
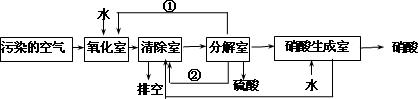
各室中发生的反应如下:
a.氧化室:NO2(g)+SO2(g)+H2O(l)![]() H2SO4(l)+NO(g) ΔH=akJ·mol-1
H2SO4(l)+NO(g) ΔH=akJ·mol-1
b.清除室:NO(g)+NO2(g)=N2O3(g) ΔH=b kJ·mol-1
N2O3(g)+2H2SO4(l)![]() 2NOHSO4(s)+H2O(l) ΔH=c kJ·mol-1
2NOHSO4(s)+H2O(l) ΔH=c kJ·mol-1
c.分解室:4NOHSO4(s)+O2(g)+2H2O(l)![]() 4H2SO4(l)+4NO2(g) ΔH=d kJ·mol-1
4H2SO4(l)+4NO2(g) ΔH=d kJ·mol-1
回答下列问题:
(4)①和②分别为(写化学式)________、________.
(5)写出SO2、O2和H2O反应生成H2SO4的热化学方程式:________.
解析:
|
(1)N2、O2(2分,只填N2也算对) (2)使氨气和大气充分混合(2分) (3)肥料(1分) (4)NO2 H2SO4(2分) (5)2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l) ΔH=(2a+2b+2c+d)kJ·mol-1(3分) |

 名校课堂系列答案
名校课堂系列答案某硝酸厂附近的空气主要污染物为氮的氧化物。为了保护环境和综合利用,可采用氨-碱两级吸收法。此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
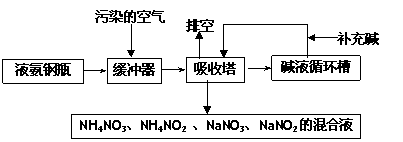 |
(1)排空物质的主要成分为____________________________。
(2)进入吸收塔以前加一个缓冲器的目的是________________________________。
(3)从吸收塔排出的混合液用途之一为________________ 。
空气的主要污染物为硫的氧化物和氮的氧化物。研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
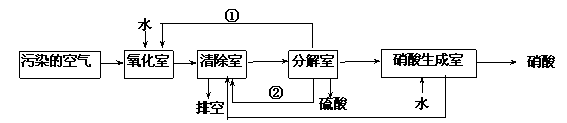
各室中发生的反应如下:
a.氧化室:NO2(g) + SO2(g) + H2O (l)=H2SO4 (l)+ NO(g)△H=a kJ·mol-1
b.清除室:NO (g)+ NO2 (g)= N2O3(g) △H= b kJ·mol-1
N2O3 (g)+ 2H2SO4(l) = 2NOHSO4 (s)+ H2O(l) △H=c kJ·mol-1
c.分解室:4NOHSO4 (s)+ O2 (g)+ 2H2O (l)= 4H2SO4 (l)+ 4NO2(g) △H= dkJ·mol-1
回答下列问题:
(4)①和②分别为(写化学式)______________、_____________。
(5)写出SO2、 O2 和 H2O反应生成H2SO4的热化学方程式:
____________________________________________________________。

