题目内容
【题目】图甲是利用一种微生物将废水中尿素![]() 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。回答下列问题:
的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。回答下列问题:
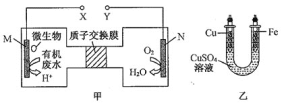
![]() 铜电极应该与 ______电极相连,Fe电极的电极反应式__________
铜电极应该与 ______电极相连,Fe电极的电极反应式__________
![]() 甲中
甲中![]() 通过质子交换膜向_____极移动,M电极的电极方程式_______
通过质子交换膜向_____极移动,M电极的电极方程式_______
![]() 当铜电极减重___g,Fe电极增重16g,N极消耗气体的体积
当铜电极减重___g,Fe电极增重16g,N极消耗气体的体积![]() 标准状况下
标准状况下![]() 为____L。
为____L。
【答案】N ![]() N
N ![]()
![]()
![]()
【解析】
根据题给信息知,甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应;在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,以此解答该题。
![]() 铁上镀铜,铜为阳极应与N电极相连,Fe电极的电极反应式为
铁上镀铜,铜为阳极应与N电极相连,Fe电极的电极反应式为![]() ,故答案为:N;
,故答案为:N;![]() ;
;
![]() 是负极,N是正极,质子透过离子交换膜由左M极移向右N极即向N极移动;
是负极,N是正极,质子透过离子交换膜由左M极移向右N极即向N极移动;
尿素在负极M上失电子发生氧化反应,电极反应式为![]() ,故答案为:N;
,故答案为:N;![]() ;
;
![]() 电极增重16g,则铜电极减重16g,即
电极增重16g,则铜电极减重16g,即![]() ,则转移
,则转移![]() 电子,N极是氧气得电子,根据1mol氧气得4mol电子,则N极消耗气体的体积
电子,N极是氧气得电子,根据1mol氧气得4mol电子,则N极消耗气体的体积![]() 标准状况下
标准状况下![]() 为
为![]() ,故答案为:16;2.8。
,故答案为:16;2.8。

练习册系列答案
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。