题目内容
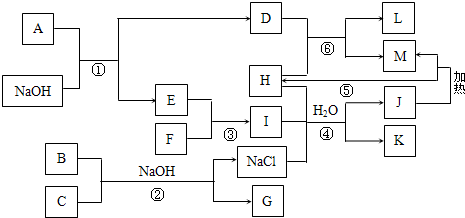
如图是部分元素的单质及其化合物的转化关系图,反应条件和部分反应中的水已略去.A、E、F是单质,B是红棕色固体,C是家用消毒液的有效成分.G是含+6价元素的含氧酸盐,摩尔质量166g/mol.L是两性物质;反应④、⑤是工业上制取M的重要方法,曾经是我国民族工业的骄傲.
(1)写出F的电子式 .
(2)写出反应①离子方程式 .
(3)写出反应④的化学方程式 .
(4)G是一种新型净水剂,化学式为 .用G代替氯气和明矾净水的原因是 .

(1)写出F的电子式
(2)写出反应①离子方程式
(3)写出反应④的化学方程式
(4)G是一种新型净水剂,化学式为
分析:G是含+6价元素的含氧酸盐,摩尔质量166g/mol,可知G为Na2FeO4,则B为Fe(OH)3,C为NaClO,题中单质A可与NaOH溶液反应生成单质E,结合L为两性化合物可知A为Al,则E为H2,D为NaAlO2,反应④、⑤是工业上制取M的重要方法,曾经是我国民族工业的骄傲,可知应为侯氏制碱法,结合J解热分解生成M可知J为NaHCO3,I应为NH3,则F为N2,H为CO2,K为NH4Cl,J分解生成M为Na2CO3,NaAlO2与CO2反应生成的L为Al(OH)3,结合对应物质的性质以及题目要求解答该题.
解答:解:G是含+6价元素的含氧酸盐,摩尔质量166g/mol,可知G为Na2FeO4,则B为Fe(OH)3,C为NaClO,题中单质A可与NaOH溶液反应生成单质E,结合L为两性化合物可知A为Al,则E为H2,D为NaAlO2,反应④、⑤是工业上制取M的重要方法,曾经是我国民族工业的骄傲,可知应为侯氏制碱法,结合J解热分解生成M可知J为NaHCO3,I应为NH3,则F为N2,H为CO2,K为NH4Cl,J分解生成M为Na2CO3,NaAlO2与CO2反应生成的L为Al(OH)3,
(1)由以上分析可知F为N2,电子式为 ,故答案为:
,故答案为: ;
;
(2)反应①为铝和氢氧化钠溶液的反应,生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)反应④为侯氏制碱法,涉及反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(4)G为Na2FeO4,为净水剂,具有强氧化性,能够消毒杀菌、遇水中还原性物质反应有Fe3+生成,Fe3+水解得到Fe(OH)3胶体,能够吸附水中的悬浮物
故答案为:Na2FeO4;Na2FeO4具有强氧化性,能够消毒杀菌、遇水中还原性物质反应有Fe3+生成,Fe3+水解得到Fe(OH)3胶体,能够吸附水中的悬浮物.
(1)由以上分析可知F为N2,电子式为
 ,故答案为:
,故答案为: ;
;(2)反应①为铝和氢氧化钠溶液的反应,生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)反应④为侯氏制碱法,涉及反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(4)G为Na2FeO4,为净水剂,具有强氧化性,能够消毒杀菌、遇水中还原性物质反应有Fe3+生成,Fe3+水解得到Fe(OH)3胶体,能够吸附水中的悬浮物
故答案为:Na2FeO4;Na2FeO4具有强氧化性,能够消毒杀菌、遇水中还原性物质反应有Fe3+生成,Fe3+水解得到Fe(OH)3胶体,能够吸附水中的悬浮物.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握常见物质的性质以及重要用途,明确题目的突破口,采用正逆推相结合的方法解答该题,难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目